
【题目】关于组成细胞的元素C的叙述正确的是( )
A. 最基本元素、 B. 基本元素 C. 微量元素 D. 大量元素
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-58kJ/mol
CH3OH(g)+H2O(g) △H=-58kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41kJ/mol
CO(g)+H2O(g) △H=+41kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | a | b | c | d | x |
则x=______。(用含表中字母的代数式表示)
(2)若将lmolCO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
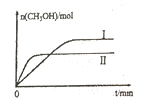
①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>或“=”或“<”)
②一定温度下,能判断该反应达到化学平衡状态的是______。
a.容器中压强不变
b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH)
d.2个C=O断裂的同时有3个H-H形成
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为_____,该温度下的平衡常数为_____,若容器容积不变,下列措施可增加甲醇产率的是____。
a.升高温度 b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇,有关热化学方程式如下:
①2CH4(g)+O2(g)==2CO(g)+4H2(g) △H1=-70.8kJmol-1
②CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
③2CH4(g)+O2(g)![]() 2CH3OH(g) △H3=-251.0 kJmol-1
2CH3OH(g) △H3=-251.0 kJmol-1
(1)反应②的△H2=________kJmol-1;
(2)在体积可变的密闭在器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强变化如图1所示。

①M 点时,H2 的转化率为_________;压强: p1_______(填“>”“<”或“=”)p2;
②反应速率:N 点v正(CO) _______(填“>”“<”或“=”)M 点v 逆(CO)
③若压强为p1、在1L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(IgK)如图2所示。则温度为506K时,平衡常数K=____________, B、C、D、E四点中能正确表示该反应的1gK 与T的关系的点为________________。
④若在2L恒容密闭容器中充入x (x>0)mol H2、2 mol CO、和8 mol CH3OH(g),在 506 K下进行上述反应。为了使该反应逆向进行,x的范围为________________。
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结论不正确的是( )
实验操作 | 现象 | 结论 | |
A | 将碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
B | 将乙醇与酸性重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
C | 将新制的氢氧化铜与葡萄糖溶液混合加热 | 产生砖红色沉淀 | 葡萄糖具有还原性 |
D | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 | 溶液褪色 | 产物不都是烷烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的化学电源示意图,有关说法不正确的是( ) 
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.铅蓄电池工作过程中,每通过 2 mol 电子,负极质量减轻 207 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废弃铬渣对人体以及环境危害极大,铬渣含有Na2SO4及少量Cr2O72-、Fe3+;某工厂从铬渣中提取硫酸钠的工艺如图1:

己知:I.Fe3+、Cr3+完全沉淀(c≦1.0×10-5mol/L)时pH分别为3.6和5;
Ⅱ.Cr2O72-还原产物为Cr3+。
(1)步骤2调节pH=3.6的目的为______,“微热”的作用为_______。
(2)Na2SO4和Na2Cr2O7的溶解度随温度变化曲线如图2,操作B的方法为_________.
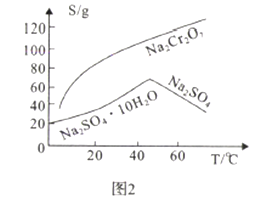
A.蒸发结晶、趁热过滤 B.蒸发浓缩,降温结晶,过滤
(3)步骤5中酸C不能选择硝酸的理由为____________,酸化、还原过程发生反应的离子方程式为_______,若将该反应设计为原电池(惰性电极),则负极的电极反应式为_______。
(4)Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=_______
(5)为了测定步骤3的滤液中Na2Cr2O7的浓度,进行步骤如下:
I.取100mL滤液;
Ⅱ.用cmol/L的标准KMnO4酸性溶液滴定bmL一定浓度的FeSO4溶液,消耗KMnO4溶液bmL;
Ⅲ.取bmL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗dmLFeSO4溶液;则步骤3的滤液中Na2Cr2O7的含量为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,a、b、c、d、e 为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )

A. 元素 b 位于ⅥA 族,有+6、-2 两种常见化合价
B. 五种元素中,元素 e 的性质最稳定
C. 原子半径有 d>c>b
D. 元素 e 参与形成的化合物可以作为一种半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( ) 
A.如图 1 所示,若铜中含有杂质银,可形成原电池,且铜作负极
B.如图 2 所示,当有 0.1 mol 电子转移时,有 0.1 mol Cu2O 生成
C.基于绿色化学理念设计的制取 Cu2O 的电解池如图 2 所示,铜电极发生还原反应
D.若图 3 所示的装置中发生 Cu+2Fe3+═Cu2++2Fe2+的反应,则 X 极是负极,Y 极的材料可 以是铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 反应MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,则该反应的△H>0
B. 原电池输出电能的能力取决于组成原电池的反应物的氧化还原能力
C. 0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com