
| A. | 该混合物中铜的质量为19.2 g | |
| B. | 与该混合物反应消耗的HNO3的量为1.2 mol | |
| C. | 加入NaOH溶液的体积是800 mL | |
| D. | Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |
分析 计算出标况下4.48LNO的物质的量,根据电子守恒计算出混合物中铜的物质的量,再根据m=nM计算出铜的质量;最终得到的固体为氧化铜,根据n=$\frac{m}{M}$计算出氧化铜的物质的量;反应消耗的硝酸为生成硝酸铜和生成NO所消耗的,根据N原子守恒计算出消耗硝酸的物质的量;铜离子完全沉淀时,溶质为硝酸钠,根据溶液中硝酸根离子的物质的量计算出氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算氢氧化钠的浓度、硝酸根离子浓度,据此进行计算.
解答 解:标况下4.48LNO的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,
根据电子守恒,原混合物中含有铜的物质的量为:n(Cu)=$\frac{0.2mol×3}{2}$=0.3mol,其质量为:64g/mol×0.3mol=19.2g,
最终得到的32.0g为氧化铜,氧化铜的物质的量为:$\frac{3.2g}{80g/mol}$=0.4mol,
根据铜原子守恒可知,原混合物中含有CuO的物质的量为:0.4mol-0.3mol=0.1mol,
0.6L 2.0mol/L稀硝酸中含有硝酸的物质的量为:2.0mol/L×0.6L=1.2mol,
A.根据分析可知,该混合物中铜的质量为19.2g,故A正确;
B.与该混合物反应的硝酸反应后生成硝酸铜和NO,根据氮原子守恒,消耗硝酸的物质的量为:0.4mol×2+0.2mol=1mol,故B错误;
C.向所得溶液中加入一定体积1.0mol/L NaOH溶液,恰好使Cu2+沉淀完全,此时溶质为硝酸钠,反应后溶液中硝酸根离子的物质的量为:1.2mol-0.2mol=1.0mol,消耗氢氧化钠的物质的量为1.0mol,消耗氢氧化钠溶液的体积为:$\frac{1mol}{1mol/L}$=1L=1000mL,故C错误;
D.铁离子完全沉淀时,根据C可知,硝酸根离子的物质的量为1mol,浓度为:$\frac{1mol}{0.6L+1L}$=0.625mol/L,故D错误;
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握电子守恒、质量守恒定律在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
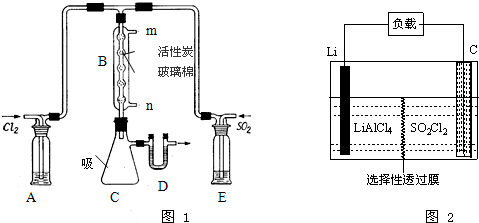
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
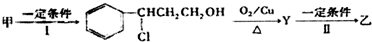
 +HCl$\stackrel{一定条件下}{→}$
+HCl$\stackrel{一定条件下}{→}$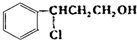 ,反应II的反应类型为消去反应.
,反应II的反应类型为消去反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用工业废水直接灌溉农田 | B. | 用可降解塑料做购物袋 | ||
| C. | 将煤气化或液化获得清洁燃料 | D. | 火力发电厂的燃煤中加适量石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应是放热反应 | |
| B. |  H2燃烧时的能量变化如图所示 | |
| C. | 化学键断裂放出能量 | |
| D. | 反应物总能量与生成物总能量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com