
【题目】焦锑酸钠(NaSbO3·3H2O)可用于搪瓷的乳白剂及铁皮、钢板的抗酸漆。一种利用高砷锑烟灰(主要成分为Sb2O3、As2O3,还含Ag、Cu、Fe的氧化物)生产焦锑酸钠的工艺流程如下:
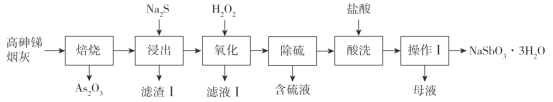
已知:i.Sb2O3、As2O3部分性质如下表:
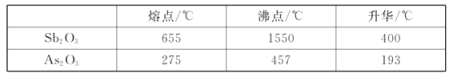
ii.Ag、Cu、Fe的氧化物不溶于Na2S溶液
iii.Na2SbO4不溶于水;NaSbO3﹒3H2O既不溶于水,也不溶于酸。
请回答下列问题:
(1)“焙烧”的最低温度为_________(填标号)
a.655℃ b.400℃ c.275℃ d.193℃
(2)“浸出”时,往往采取比常温稍高的浸液温度,且选用较高浓度的Na2S溶液,采取这些措施的目的是_________________________________________。“浸出”时,Sb2O3转化为Na3SbS3的化学方程式为__________________________________________,滤渣Ⅰ是____________。
(3)“氧化”时所用H2O2的电子式为___________,氧化产物为Na3SbO4和____________.
(4)“酸洗”的作用是______________________。(用化学方程式表示)
(5)As2O3对应的酸为H3AsO3,测得某工业酸性废液中含H3AsO3和Fe2+,其浓度如表:

已知:iV.Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21。
V.H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用______________方法除去该废水中的砷,除去砷后的废液中c(AsO43-)=__________________(不考虑反应过程中溶液体积的微小变化)
【答案】d 提高浸出速率 Sb2O3+6Na2S+3H2O=2Na3SbS3+6NaOH Ag、Cu、Fe的氧化物 ![]() S Na3SbO4+2HCl+2H2O=NaSbO3·3H2O+2NaCl 氧化 4.75×10-19mol·L-l
S Na3SbO4+2HCl+2H2O=NaSbO3·3H2O+2NaCl 氧化 4.75×10-19mol·L-l
【解析】
高砷锑烟灰(主要成分为Sb2O3、As2O3,还含Ag、Cu、Fe的氧化物),焙烧,As2O3因升华而分离出;加入硫化钠溶液,将Ag、Cu、Fe的氧化物除去,Sb2O3转化为Na3SbS3,反应为:Sb2O3+6Na2S+3H2O=Na3SbS3+6NaOH;加入过氧化氢,可将Na3SbS3氧化生成Na3SbO4和S,过滤得到Na3SbO4和S的混合物,然后进行除硫,过滤得到Na3SbO4,加入盐酸,可生成NaSbO33H2O,过滤得到NaSbO33H2O,以此解答该题。
(1)焙烧的目的是使As2O3升华,根据题目信息可知193℃时,As2O3升华,所以选d;
(2)“浸出”时,往往采取比常温稍高的浸液温度,且选用较高浓度的Na2S溶液,采取这些措施的目的是增大浸出速率,提高Sb的浸出率;“浸出”时,Sb2O3转化为Na3SbS3,根据各元素的化合价可知该过程不是氧化还原反应,硫化钠溶液显碱性,再根据元素守恒可得化学方程式为:Sb2O3+6Na2S+3H2O=Na3SbS3+6NaOH;Ag、Cu、Fe的氧化物不溶于Na2S溶液,故滤渣I为Ag、Cu、Fe的氧化物;
(3)H2O2的电子式为:![]() ;过氧化氢具有氧化性,可将Na3SbS3中的Sb元素和S元素氧化生成Na3SbO4和S;
;过氧化氢具有氧化性,可将Na3SbS3中的Sb元素和S元素氧化生成Na3SbO4和S;
(4)由流程可知,“酸洗”得到产品NaSbO3·3H2O沉淀,没有元素化合价发生变化,根据元素守恒可得反应方程式为:Na3SbO4+2HCl+3H2O=NaSbO3·3H2O+2NaCl;
(5)根据题目信息可知FeAsO4更容易沉淀,H3AsO3的还原性比Fe2+强,可加入适当的氧化剂将其中H3AsO3和Fe2+氧化得到FeAsO4沉淀;已知:Ksp(FeAsO4)=5.70×10-21,H3AsO3为0.378g/L,则c(H3AsO3)=![]() =0.003mol/L,同理c(Fe3+)= c(Fe2+)=
=0.003mol/L,同理c(Fe3+)= c(Fe2+)=![]() =0.015mol/L,所以加入足量氧化剂后,H3AsO3转化为FeAsO4沉淀,Fe3+剩余,则除去砷后的废液中c(AsO43-)=
=0.015mol/L,所以加入足量氧化剂后,H3AsO3转化为FeAsO4沉淀,Fe3+剩余,则除去砷后的废液中c(AsO43-)=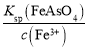 =
=![]() mol/L=4.75×10-19mol/L。
mol/L=4.75×10-19mol/L。


科目:高中化学 来源: 题型:
【题目】在2 L恒容密闭容器中充入![]() 、
、![]() ,在一定条件下发生如下反应:
,在一定条件下发生如下反应:![]()
![]() ;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
;CO的平衡转化率与温度、压强之间的关系如图所示。下列推断正确的是( )
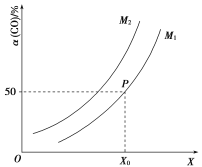
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图象中X代表温度,![]()
C.图象中P点代表的平衡常数K为![]()
D.温度和容积不变,再充入![]() 、1 mol CO,达到平衡时CO的转化率减小
、1 mol CO,达到平衡时CO的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒压下,将CO2和H2以体积比1∶4混合进行反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
CH4(g)+2H2O(g)(假定过程中无其他反应发生),用Ru/TiO2催化反应相同时间,测得CO2转化率随温度变化情况如图所示。下列说法正确的是( )
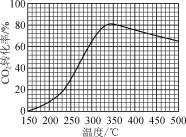
A.反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)的ΔH>0
B.图中450 ℃时,延长反应时间无法提高CO2的转化率
C.350 ℃时,c(H2)起始=0.4 mol·L-1,CO2平衡转化率为80%,则平衡常数K<2 500
D.当温度从400 ℃升高至500 ℃,反应处于平衡状态时,v(400℃)逆>v(500℃)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)设阿伏加德罗常数为NA,标准状况下,某O2和N2的混合气体m g含有b个分子,则ng该混合气体在相同状况下所占的体积是___L。
(2)在xR2++yH++O2═mR3++nH2O的离子方程式中,对化学计量数m和R2+、R3+判断正确的是___。
A.m=y,R3+是氧化产物 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(3)用双线桥法标出下列反应的电子转移方向和数目。___
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物的结构表示为![]() ,其名称是________________________。
,其名称是________________________。
(2)写出下列反应的化学方程式:
①草酸能使酸性高锰酸钾溶液褪色:____________________________________。
②把浓硝酸、浓硫酸和甲苯混合加热制备TNT:______________________________。
③溴乙烷在一定条件下发生消去反应:__________________________________。
(3)某烃A分子中碳的质量分数为90.57%,在某温度下V L该烃的蒸气质量是相同状况下V L H2质量的53倍,则烃A的分子式为______________;若烃A分子中含有苯环,且苯环上的一氯代物只有一种,则A的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种双室微生物燃料电池污水净化系统原理如图所示,图中酸性污水中含有的有机物用C6H12O6表示。下列有关该电池的说法不正确的是( )
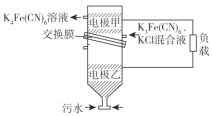
A.正极的电极反应为Fe(CN)63-+ e- =Fe(CN)64-
B.电池的总反应为C6H12O6 + 24Fe(CN)63-+6H2O=6CO2↑+Fe(CN)64-+24H+
C.该“交换膜”可选用“质子交换膜”
D.若将“K4Fe(CN)6溶液”改为“O2”,当有22.4L O2参与反应时,理论上转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温常压下,14gN2含有的分子数约为3.01×1023
B.64gSO2含有的氧原子数约为6.02×1023
C.标准状况下,22.4LH2O含有的分子数约为6.02×1023
D.2L0.5molL1MgCl2溶液中,含有的Cl-数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月17日下午,在国务院联防联控机制发布会上,科技部生物中心副主任孙燕荣告诉记者:磷酸氯喹对“COVID-19”的治疗有明确的疗效,该药是上市多年的老药,用于广泛人群治疗的安全性是可控的。其合成路线如图所示:

已知:醛基在一定条件下可以还原成甲基。回答下列问题:
(1)有机物A为糠醛,它广泛存在于各种农副产品中。A中含氧官能团的名称为______,A与新制氢氧化铜悬浊液反应的化学方程式为_______。
(2)C的结构简式为________,D与E之间的关系为_______。
(3)反应⑦的反应类型为_______;反应⑤若温度过高会发生副反应,其有机副产物的结构简式为____。
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有______种,在这些同分异构体中,有一种是羧酸,且含有手性碳原子,其名称为_________。
(5)以2—丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:_________(用箭头表示转化关系,箭头上注明试剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算下列各题:
(1)在标准状况下,CO和CO2的混合气体共17.92L,质量为27.2g,则两种气体的物质的量之和为________ mol,其中CO2为________ mol,CO占总体积的________,混合气体的摩尔质量为________。
(2)在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO在标准状况下的体积为
_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com