
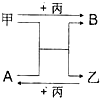
 甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题:
甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题: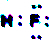 ,甲为Si,丙为F2,B为SiF4,结构式为
,甲为Si,丙为F2,B为SiF4,结构式为 ,乙为H2,
,乙为H2,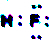 ;
; ;
;
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:
某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 |
| B、取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
| C、用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH |
| D、向10mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
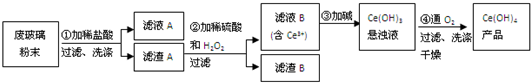
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应容器的压强不随时间而变化 |
| B、A气体和B气体的生成速率相等 |
| C、A、B、C三种气体的生成速率相等 |
| D、反应混合气体的密度不随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电负性:F>O>N |
| B、第一电离能:Mg>Al>Na |
| C、结合质子能力:OH-<CH3COO-<Cl- |
| D、稳定性:H2O>H2S>H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将试管直立,然后向其中加入块状大理石 |
| B、向盛有某溶液的试管中倾倒稀硫酸检验是否有Ba2+存在 |
| C、实验用完的药品一定要放回原试剂瓶中 |
| D、过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com