
【题目】研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
C(s)+H20(g)![]() CO(g)+H2(g) △H=+131kJ/mol
CO(g)+H2(g) △H=+131kJ/mol
②CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H=akJ/mol
CH4(g)+H2O(g) △H=akJ/mol
查阅资料反应②中相关化学键键能数据如下表:
化学键 |
| H-H | H—C | H-O |
E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)煤直接甲烷化反应C(s)+2H2(g)![]() CH4(g)的△H为_______kJ/mol,该反应在______(填“髙温”或“低温”)下自发进行。
CH4(g)的△H为_______kJ/mol,该反应在______(填“髙温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:
2C02(g)+6H2(g)![]() C2H4(g)+4H20(g) △H=-128kJ/mol,测得温度对催化剂催化效率和 C02平衡转化率的影响如图所示:
C2H4(g)+4H20(g) △H=-128kJ/mol,测得温度对催化剂催化效率和 C02平衡转化率的影响如图所示:
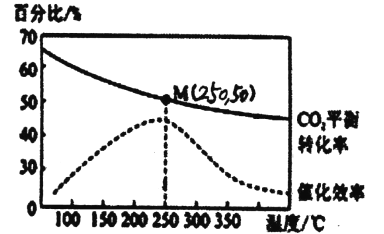
(2)图中低温时,随着温度升高催化剂的催化效率提高,但C02的平衡转化率却反而降低,其原因是__________。
(3)250℃时,该反应的平衡常数K值为__________。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入lmolC02和3molH2,发生反应:C02(g)+3H2(g)![]() CH30H(g)+H20(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH30H(g)+H20(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(4)反应前1小时内的平均反应速率V(H2)为_________mol/(L·h),该温度下C02的平衡转化率为_________。
IV.电解逆转化制乙醇
(5)科研人员通过反复实验发现:C02可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在_________极(“阴”或“阳”),该电极的反应式为_________。
【答案】-75 低温 △H<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低 1 0.3 40% 阴 2CO2+12H++12e-=CH3CH2OH+3H2O
【解析】
(1)根据盖斯定律分析解答,反应若自发进行,则△G=△H -T△S<0;
(2)根据温度对催化剂的催化活性和对平衡移动的影响分析CO2的平衡转化率;
(3)利用化学平衡常数的定义式计算;
(4)根据在恒容密闭容器内,气体的压强比等于气体的物质的量的比,计算出H2物质的量的改变值,再根据速率的定义计算,同时利用变化关系式计算出平衡时CO2改变的物质的量,利用物质的转化率为质量除以起始量,计算出该温度下CO2的平衡转化率;
(5)根据阳极发生氧化反应,阴极发生还原反应,结合溶液的酸碱性书写电极反应式。
(1)根据反应方程式①CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H=akJ/mol可知:△H=(1072+436×3-4×414-2×465)kJ/mol=-206kJ/mol,由①+②整理可得:C(s)+2H2(g)
CH4(g)+H2O(g) △H=akJ/mol可知:△H=(1072+436×3-4×414-2×465)kJ/mol=-206kJ/mol,由①+②整理可得:C(s)+2H2(g)![]() CH4(g)的△H=+131kJ/mol+(-206kJ/mol)=-75kJ/mol,该反应是气体体积减小的放热反应,根据体系的自由能公式△G=△H-T△S,若反应自发进行,则△G=△H -T△S<0,所以温度较低时△G<0,反应自发进行,故答案为:-75,低温。
CH4(g)的△H=+131kJ/mol+(-206kJ/mol)=-75kJ/mol,该反应是气体体积减小的放热反应,根据体系的自由能公式△G=△H-T△S,若反应自发进行,则△G=△H -T△S<0,所以温度较低时△G<0,反应自发进行,故答案为:-75,低温。
(2)由图分析可知在250℃时催化剂活性最大,在低于该温度时,升高温度,催化剂活性增强,而CO2的平衡转化率随着温度的升高而降低,是由于该反应的正反应是放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使反应物CO2的转化率降低,故答案为:△H<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低。
(3)在250℃时CO2的平衡转化率为50%,根据起始时加入的物质的物质的量及反应2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)中各种物质的转化关系可知,达到平衡时各种物质的平衡浓度分别为c(CO2)=0.5mol/L,c(H2)=1.0mol/L,c(C2H4)=0.25mol/L,c(H2O)=1.0mol/L,则该温度下的化学平衡常数K=0.25×14/0/52×16=1,故答案为:1。
C2H4(g)+4H2O(g)中各种物质的转化关系可知,达到平衡时各种物质的平衡浓度分别为c(CO2)=0.5mol/L,c(H2)=1.0mol/L,c(C2H4)=0.25mol/L,c(H2O)=1.0mol/L,则该温度下的化学平衡常数K=0.25×14/0/52×16=1,故答案为:1。
(4)化学反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
n(开始)/mol 1 3 0 0
1h/mol x 3x x x
△n/mol y 3y y y
在1h时气体的总物质的量n=1-x+3-3x+x+x=(4-2x)mol,开始时总物质的量为4mol,根据P后/P前=(4-2x)/4=0.90,解得x=0.2mol,所以H2改变的物质的量为3×0.2mol=0.6mol,V(H2)=△c/△t=0.6mol/2L/1h=0.3mol/(L·h),在平衡时气体的总物质的量n=1-y+3-3y+y+y=(4-2y)mol,开始时总物质的量为4mol,根据P后/P前=(4-2y)/4=0.80,解得y=0.4mol,所以CO的平衡转化率为0.4mol/1mol×100%=40%,故答案为:0.3,40%。
(5)CO2中碳元素的化合价为+4价,乙醇CH3CH2OH中C的平均化合价为-2价,化合价降低,获得电子,所以生成乙醇的反应发生在阴极,在酸性条件下,CO2在阴极获得电子,变成乙醇,电极反应式为2CO2+12H++12e-=CH3CH2OH+3H2O,故答案为:阴,2CO2+12H++12e-=CH3CH2OH+3H2O。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.配制480 mL 0.2mol/L NaOH溶液。具体如下:
(1)需______gNaOH。
(2)配制过程中,下列仪器不会用到的是__________(填序号),尚缺少的玻璃仪器是______________。
A.托盘天平 B.250mL容量瓶 C.玻璃棒 D.胶头滴管
(3)实验过程中两次用到玻璃棒,其作用分别是:______________、_________。
(4)定容操作:将蒸馏水注入所选的容器中,直到其中液面接近其刻度线____________处时,改用____________滴加蒸馏水至溶液的__________正好与刻度线_______。将瓶塞子盖好,反复____________摇匀。
(5)下列操作的正确顺序是(用字母表示)B→_____→________→______→__________→_____→G。
A.转移 B.称量 C.定容 D.洗涤 E.冷却 F.溶解 G.摇匀
II.乙同学用18.4mol/l浓硫酸配制100ml 3.6mol/L的稀硫酸。
用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。
指出其中错误之处____________________________。
III.在配制一定物质的量浓度溶液时,下列操作出现的后果是(填:“偏低”.“偏高”.“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,容量瓶中有少量水。______________。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度____________。
(4)转移时不慎将溶液倒在瓶外;____________;
(5)定容时俯视容量瓶刻度线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T ℃时,NH3+NH3![]() NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-14
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是大气污染物之一。工业上在一定的温度和催化剂条件下,可用NH3来消除NOx的污染,生成两种对环境无害的物质。
(1)请写出NH3与NO2反应的化学方程式____。
(2)①写出实验室中由固体物质制取氨气的化学方程式__;
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)
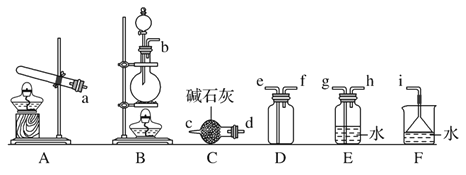
(3)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。

①写出电解时NO2发生反应的电极反应式:___。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制乙烯并检验其性质的装置图,请回答:
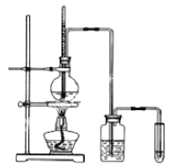
(1)写出圆底烧瓶中反应的方程式______________________________;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:____________________________________________;
(3)为了检验乙烯的生成及乙烯的不饱和性,试管中应盛放_________,现象为___________;
(4)洗瓶中盛放的试剂为____________________,作用__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)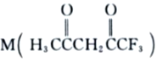 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。
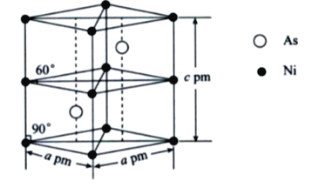
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com