
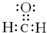 ; B的结构简式CH3CH2CHO;B的物质的量0.06mol;
; B的结构简式CH3CH2CHO;B的物质的量0.06mol;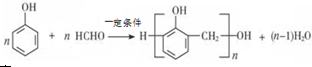 .
. 分析 (1)混合醛的物质的量为0.08mol,生成的Ag为0.2mol,若不含甲醛,由-CHO~2Ag,可知生成的Ag为0.08mol×2=0.16mol<0.2mol,故一定含有HCHO,由于相对分子质量MA<MB,则A为HCHO,利用总质量、生成Ag的物质的量列方程计算各自物质的量,进而计算B的质量,再计算B的相对分子质量,结合饱和一元醛CnH2nO确定B的分子式,进而确定B的结构简式;
(2)苯酚与甲醛发生缩聚反应生成酚醛树脂.
解答 解:(1)混合醛的物质的量为0.08mol,生成的Ag为0.2mol,若不含甲醛,由-CHO~2Ag,可知生成的Ag为0.08mol×2=0.16mol<0.2mol,故一定含有HCHO,由于相对分子质量MA<MB,则A为HCHO,电子式为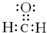 ;
;
设混合物中含有HCHO的物质的量为xmol,B的分子式为CnH2nO,其物质的量为ymol,
则根据总质量及平均相对分子量可得:①51(x+y)=4.08,
根据生成银的物质的量可得:②4x+2y=0.2,
联立①②可得:x=0.02,y=0.06,
所以30×0.02+(14n+16)×0.06=4.08,解得:n=3,B为CH3CH2CHO,
故答案为: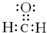 ;CH3CH2CHO;0.06mol;
;CH3CH2CHO;0.06mol;
(2)苯酚与甲醛发生缩聚反应生成酚醛树脂,反应方程式为:,
故答案为: .
.
点评 本题考查有机物分子式与结构的确定、混合物的计算,题目难度中等,根据醛基与银的关系式确定混合物中含有甲醛为解答关键.


科目:高中化学 来源: 题型:选择题
| A. | Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO | |
| B. | BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO | |
| C. | Be(OH)2只能溶于盐酸,不能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
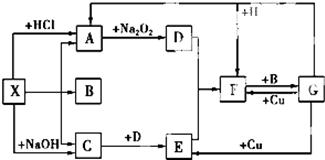 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题:
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1molX分解得到A、B、C各1mol.试回答下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应 | |
| B. | NaHCO3俗称小苏打,Na2CO3俗称苏打或纯碱 | |
| C. | Na2CO3很稳定,而NaHCO3受热时容易分解 | |
| D. | 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解液中KOH的物质的量浓度不变 | |
| C. | 该燃料电池的总反应方程式为O2+2H2═2H2O | |
| D. | 用该燃料电池CuCl2溶液,产生2.24LCl2(标况)时,有0.2mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com