
分析 (1)生成1mol氨气放出46.1kJ热量,则生成2mol氨气放出92.2kJ燃量;
(2)钢铁发生吸氧腐蚀时,正极上氧气得电子和水反应生成氢氧根离子;
(3)甲烷、氧气酸性原电池中,负极上甲烷失电子生成二氧化碳和氢离子.
解答 解:(1)生成1mol氨气放出46.1kJ热量,则生成2mol氨气放出92.2kJ燃量,所以该反应热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ•mol-1,故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ•mol-1;
(2)钢铁发生吸氧腐蚀时,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-═4OH-,故答案为:O2+2H2O+4e-═4OH-;
(3)甲烷、氧气酸性原电池中,负极上甲烷失电子生成二氧化碳和氢离,电极反应式为CH4+2H2O-8e-=CO2+8H+,故答案为:CH4+2H2O-8e-=CO2+8H+.
点评 本题考查电极反应式、热化学方程式的书写,为高频考点,明确原电池原理、热化学方程式书写规则即可解答,注意燃料电池电极反应式的书写与电解质溶液酸碱性有关,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠钾的合金在常温下是液体,可用于快中子反应堆热交换剂 | |
| B. | 漂白粉可以用来漂白、消毒杀菌.其有效成分是次氯酸钙 | |
| C. | 碳酸钠俗称纯碱,是焙制糕点所用的发酵粉的主要成分 | |
| D. | 镁和某些金属构成合金,硬度和强度都较大,可用于飞机、火箭等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释后,溶液中c(H+)减小 | |
| B. | 加入少量NaOH固体,电离度增大,溶液的pH增大 | |
| C. | 加入少量NH4Cl固体,氨水电离平衡向右移动 | |
| D. | 通入少量HCl气体后,电离平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| A | - | - | ↑ | |
| B | - | ↓ | ↓ | |
| C | - | ↓ | - | |
| D | ↑ | ↓ | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | A.实验室制取并收集O2 | B.检验装置气密性 | C.制取蒸馏水 | D.分离水和四氯化碳 |
| 装置或操作 | 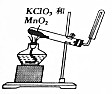 | 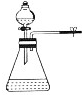 | 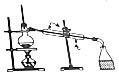 | 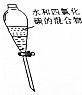 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com