
 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:

科目:高中化学 来源: 题型:
| A、自发反应的熵一定增大,非自发反应的熵一定减小 |
| B、非自发反应在任何情况下都不会发生 |
| C、常温下,反应C(s)+CO2(g)?2CO(g)不能自发进行,则该反应的△H>0 |
| D、需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
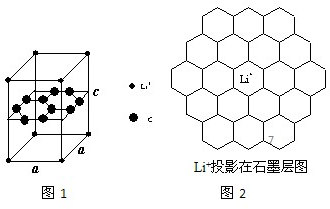
| BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 | |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:

 △H1=-125KJ/mol
△H1=-125KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
 在5-氨基四唑(
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
科目:高中化学 来源: 题型:
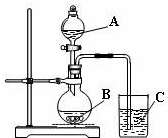 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com