
 A、B、C、D、E、F六种元素的原子序数依次递增.已知:
A、B、C、D、E、F六种元素的原子序数依次递增.已知:分析 A、B、C、D、E、F六种元素的原子序数依次递增,
①F的原子序数为25,其余均为短周期元素,F为Mn元素;
②元素A与元素B同周期,元素A与元素E同主族,且A、B、E三原子p轨道上均有2个未成对电子,这几种原子序数都小于F,所以AB位于第二周期、E位于第三周期,A为C、B为O、E为Si元素;
③元素C、D、E在同一周期,且C原子中没有未成对电子,为第三周期,原子序数小于Si,则C是Mg、D为Al元素;
(1)同一周期元素,元素电负性随着原子序数增大而增大;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(2)F是Mn元素,根据构造原理书写该原子核外电子排布式;
(3)B是O元素,E是Si元素,元素B与元素E形成的晶体是二氧化硅晶体,二氧化硅晶体是原子晶体;二氧化硅晶体中Si-O原子之间形成共价单键;
(4)A是C元素,B是O元素,由氢元素与A、B两元素共同构成的相对分子质量为30的分子是HCHO,甲醛分子中中心原子是碳原子,碳原子含有3个σ键且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式及空间构型;
(5)价电子数相同原子个数相同的微粒互为等电子体,等电子体结构相似;
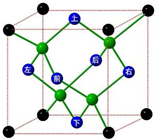
(6)晶体中最近的两个原子之间的距离为该晶体晶胞体长的$\frac{1}{4}$,该晶胞中原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,该晶胞体积=$\frac{\frac{12}{{N}_{A}}×8}{ρ}$cm3,该晶胞体长=$\sqrt{3}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm.
解答 解:A、B、C、D、E、F六种元素的原子序数依次递增,
①F的原子序数为25,其余均为短周期元素,则F是Mn元素;
②元素A与元素B同周期,元素A与元素E同主族,A、B、E三原子p轨道上均有2个未成对电子,A的原子序数最小,则A是C元素,A和B同周期,则B是O元素,E原子序数大于B,所以E位于第三周期,则E是Si元素;
③元素C、D、E在同一周期,且C原子中没有未成对电子,C的原子序数小于E,则C是Mg,D的原子序数大于C小于E,则D是Al元素,
(1)A是C元素,B是O元素,同一周期元素中,元素的电负性随着原子序数的增大而增大,所以元素A与元素B的电负性大小比较为O>C;
C是Mg元素,D是Al元素,同一周期中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族元素大于相邻主族元素的第一电离能,所以元素C与元素D的第一电离能的大小比较为:Mg>Al,
故答案为:O;C;Mg;Al;
(2)F是Mn元素,其原子核外有25个电子,根据构造原理知,F的核外电子排布式为[Ar]3d54s1或1s22s22p63s23p63d54s1,故答案为:[Ar]3d54s1或1s22s22p63s23p63d54s1 ;
(3)B是O元素,E是Si元素,元素B与元素E形成的晶体是二氧化硅晶体,二氧化硅晶体的构成微粒是原子,所属的晶体类型为原子晶体,在该晶体中每个硅原子和4个氧原子形成4个硅氧键,每个氧原子和2个硅原子形成2个硅氧键,原子间以共价单键相结合,所以原子间形成的共价键属于σ键,故选A,
故答案为:原子;A;
(4)A是C元素,B是O元素,由氢元素与A、B两元素共同构成的相对分子质量为30的分子是HCHO,甲醛分子中中心原子是碳原子,碳原子含有3个σ键且不含孤电子对,所以甲醛里中心原子的杂化轨道类型为sp2,分子的空间构型为平面三角形,
故答案为:sp2;平面三角形;
(5)根据等电子原理,A是C元素,B是O元素,由元素A与元素B构成的一种双原子极性分子是CO,CO和氮气分子实验等电子体,等电子体的结构相似,所以一氧化氮的结构式为:C≡O,
故答案为:C≡O;
(6)晶体中最近的两个原子之间的距离为该晶体晶胞体长的$\frac{1}{4}$,该晶胞中原子个数=4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,该晶胞体积=$\frac{\frac{12}{{N}_{A}}×8}{ρ}$cm3,该晶胞体长=$\sqrt{3}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm,晶体中最近的两个原子之间的距离为该晶体晶胞体长的$\frac{1}{4}$=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、原子核外电子排布、元素周期律等知识点,侧重考查学生分析判断及空间想象能力、计算能力等,明确基本理论及物质结构是解本题关键,要知道该晶胞中哪两个原子距离最近是解答本题难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| B. | 胶体的分散质粒子直径在1nm~100nm之间 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44 g CO2 气体中含有原子数为2NA | |
| B. | 常温常压下22.4 L H2 中含原子数为2NA | |
| C. | 64g二氧化硫含有原子数为3NA | |
| D. | 标准状况下22.4 L H2O中含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,是非极性分子(填“极性”或“非极性”),一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O
,是非极性分子(填“极性”或“非极性”),一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化了的硝酸钡溶液,有白色沉淀生成 | |
| B. | 加入盐酸酸化了的氯化钡溶液,有白色沉淀生成 | |
| C. | 先加硝酸酸化,无沉淀,再加硝酸钡溶液,有白色沉淀生成 | |
| D. | 先加盐酸酸化,无现象,再加氯化钡溶液,有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、OH-、Cl- | B. | H+、Mg2+、NO3-、SiO32- | ||
| C. | Fe3+、NH4+、SCN-、F- | D. | Na+、Cu2+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com