
����Ŀ��ij����֣���Ҫ�ɷ�ΪFe����Ʒ�к�������ͭ����ȣ������ɷֺ��ԣ���Ϊ�˲ⶨ�úϽ������ĺ���������������¹������̣�

��1������A����Ҫ����__________��__________��������ʹ�õIJ���������__________
��2��д������ҺA��ͨ��Cl2����������Ӧ�����ӷ���ʽ:__________,д���������NaOH��Һ��������Ӧ�����ӷ���ʽ__________.
��3��ʵ���ҽ��в�����õ�������������ǯ���ƾ��ơ����żܡ�__________��__________
��4��������Fe2O3�������������Ϊb g���������Ʒ����Ԫ�ص������ٷ����ı���ʽΪ__________���ú�a��b��ʽ�ӱ�ʾ��
��5����ͬѧ�������Լ��������һ����,Ҳ�ﵽ��ͬ����Ŀ�ģ����μ�����Լ��ǣ��������� NaOH��Һ��__________��__________�� �������� NaOH��Һ���������յ�Fe2O3������
���𰸡� �衢ͭ ©�����ձ��������� 2 Fe2��+Cl2 �� 2Fe3��+ 2Cl�� Fe3�� + 3OH�� �� Fe(OH)3�� Al3�� + 4OH�� �� AlO2�� +2H2O ���� ������ (7b/10a)��100% {��(70b/a)%} ������������ ͨ��������
����������������������(��Ҫ�ɷ�ΪFe)��Ʒ�к�������ͭ�ȣ���������ϡ�����������ܽ�Ϊ�Ȼ��������Ȼ�����Һ��ͭ���費�ܽ⣬���˵õ�����AΪͭ���裬��ҺA�к��е����ʳɷ�ΪFeCl2��AlCl3��ͨ���������Ȼ���������Ϊ�Ȼ�����2FeCl2+Cl2=2FeCl3���õ���ҺB��ΪFeCl3��AlCl3��B��Һ�м����������������Һ��ӦΪ:FeCl3+3NaOH=Fe(OH)3��+3NaCl��AlCl3+4NaOH=NaAlO2+3NaCl�����˵õ����ɫ����������������ҺC����ҺC�к��е�����NaAlO2��NaCl��NaOH�����ɫ���������������ȷֽ�õ���������
�������������Ϸ�������1������A����Ҫ����ͭ���裻�����ǹ��ˣ�����ʹ�õIJ���������©�����ձ���������
��2����ҺA��FeCl2��AlCl3��ͨ��Cl2���������Ȼ���������Ϊ�Ȼ���������������Ӧ�����ӷ���ʽ: 2 Fe2��+Cl2 �� 2Fe3��+ 2Cl�� ��FeCl3��AlCl3�����NaOH��Һ��������Ӧ�����ӷ���ʽFe3��+ 3OH���� Fe(OH)3���� Al3��+ 4OH���� AlO2��+2H2O ��
��3������������գ��õ�������������ǯ���ƾ��ơ����żܡ���������������
��4��������Ԫ���غ㣬����Ʒ����Ԫ�ص������ٷ����ı���ʽΪ![]() (7b/10a)��100%
(7b/10a)��100%
��5����ͬѧ�������Լ��������һ����,Ҳ�ﵽ��ͬ����Ŀ�ģ����μ�����Լ��ǣ��������� NaOH��Һ���������ܽ���������������м��������������Ȼ�����������������Һ��ͨ���������Ȼ���������Ϊ�Ȼ������� �������� NaOH��Һ���������յ�Fe2O3������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʳ������ʳ����������������ж����ǣ� ��
A. ����� B. ���� C. ƻ�� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ͻ��������������ʵıȽ������ʾ�� ��
��Ŀ | �۵�/��C | �ܶ�/ | Ӳ�ȣ���� | ������ |
ij�Ͻ� | 2 500 | 3.00 | 7.4 | 2.3 |
�� | 1 535 | 7.86 | 4.5 | 17 |
�����ܿ����úϽ��ʺ��ƣ� ��
A.����
B.�Ŵ���
C.¯��
D.�ɻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ����ӵ�����(NA)��˵������������� ����
A. 22.4L O2������ԭ����ĿΪNA B. 0.5mol H2O���е�ԭ����ĿΪ1.5NA
C. 1mol H2O���е�H2O������ĿΪNA D. 05 NA���������ӵ����ʵ�����0.5mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ�����������ܶ�Ϊ1.19gcm��3��������������Ϊ36.5%��Ũ���ᷴӦ��ȡ������
I����Ӧ����ʽ���£�___KClO3+ HCl= KCl+ Cl2��+ H2O
��1����ƽ����ʽ������˫���ŷ���ʾ������Ӧ�е���ת�Ƶķ������Ŀ��
��2������Ӧ�б�����������Ϊ5mol�������ɵ��������Ϊ__________����״���£���
II����ͬѧ�����ͼ��ʾװ���о������ܷ���ˮ������Ӧ������a�Ǻ�������������ˮ��������������ش��������⣺

��1��֤��������ˮ��Ӧ��ʵ������Ϊ__________����Ӧ�Ļ�ѧ����ʽ��__________��
��2����������ͨ��ʯ������ȡƯ�ۣ���Ӧ�Ļ�ѧ����ʽ��__________��Ư������ˮ�����������е�CO2��������Ư�ס�ɱ�����ã���Ӧ�Ļ�ѧ����ʽ��__________��
III.��ͬѧ������Ũ��������0.100 mol��L-1��ϡ����480 mL,����˵����ȷ����__________��
A��ȡ��240 mL������ƿ
B��Ӧ��ȡ����Ũ��������Ϊ4.2mL
C������ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�����ˮ��̶������У�������ҺŨ��ƫС
D������ʱ�����ӿ̶���������ҺŨ��ƫ��
E����ȡ����Ũ��������ʱ���ӿ̶���������ҺŨ��ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������3d�ܼ�ԾǨ��4p�ܼ�ʱ����ͨ��������ֱ����ȡ��������
A. ���ӵ��˶��켣ͼ��B. ԭ�ӵ����չ���
C. ���������С��ͼ��D. ԭ�ӵķ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1mol�����л�ѧ����Ҫ����436kJ��������1mol�����еĻ�ѧ����Ҫ����496kJ���������γ�1molH��O���ۼ��ų�463kJ����������Ӧ2H2(g)+O2(g)=2H2O(g)�������仯����ͼ��ʾ������˵����ȷ����

A. 2H(g)��H2(g) ![]() H ��0
H ��0
B. ͼ��E1 = 932kJ
C. ͼ��E2 = 926 kJ
D. 2H2(g)+O2(g)=2H2O(g) ![]() H =��484 kJ��mol��1
H =��484 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������������ˮ�е�ijЩ�ɷ֣����������ʣ�û�й�ϵ���ǣ� ��
A.��NaHCO3�������������ˮ�У�����ɫ���ݣ�H+��
B.ʹ��ɫ������ɫ��HCl��
C.��FeCl2��Һ�еμ���ˮ���ٵμ�KSCN��Һ�����ֳʺ�ɫ��Cl2��
D.�μ�AgNO3��Һ���ɰ�ɫ������Cl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijҩ��H�ĺϳ�·������ͼ��ʾ���Իش��������⣺
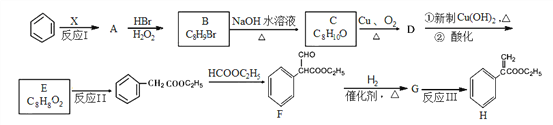
��1����Ӧ����XΪ������������������뱽��ͬ����X������______________��
��2��д�ṹ��ʽ��A__________��D_____________��
��3��д����Ӧ��ķ�Ӧ������_________________��
��4��д����Ӧ���ͣ�A��B__________��C��D__________��
��5��д��G��H�Ļ�ѧ��Ӧ����ʽ��________________________________________��
��6��д��������������������E��ͬ���칹��Ľṹ��ʽ��____________��___________��
�ٷ���������Ӧ �ڱ�������2��ȡ���� �����ڲ�ͬ�����л���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com