
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。
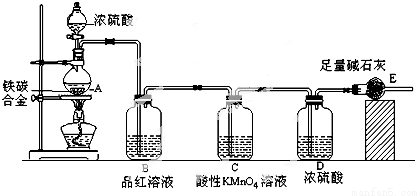
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是①常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)B中的现象是 ;C的作用是 。
(4)随着反应的进行,A中还可能发生某些离子反应,写出相应的离子方程式
反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是 ;
(5)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写含m、b的表达式)。
(6)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是 (填写代号)。
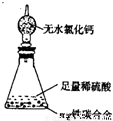
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、称量残渣的质量
C.测定反应前后装置和药品的总质量
(1)②铁在浓硫酸中纯化
(2)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(3)B中:品红溶液褪色 C中:除去SO2
(4)2Fe3++Fe═3Fe2+或Fe+2H+═Fe2++H2↑ 铁、碳在溶液中形成原电池
(5)(11m-3b)/11m
(6)C
【解析】(1)②常温下铁与浓硫酸发生钝化;
(3)在加热条件下,铁与碳均与浓硫酸反应,浓硫酸被还原为二氧化硫,碳氧化为二氧化硫,所以B中的现象是品红溶液褪色;为了防止二氧化硫对测定二氧化碳的干扰,C的作用是除去二氧化硫;
(4)随着反应进行浓硫酸变稀后,铁足够量时,可以和反应生成的硫酸铁反应生成硫酸亚铁,铁与剩余稀硫酸反应生成硫酸亚铁和氢气,所以离子方程式为:2Fe3++Fe═3Fe2+或Fe+2H+═Fe2++H2↑;铁碳在酸溶液中符合原电池的组成条件,形成原电池反应,原电池能加快化学反应速率。
(5)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量=12b/44=3b/11g,含铁的质量为mg-3b/11。则铁的质量分数是(11m-3b)/11m
(6)因为铁碳合金中的铁可以与稀硫酸反应生成氢气,瓶总质量的减少量即为氢气的生成量,而铁的质量可以通过释放氢气的质量求出,进而计算铁的质量分数;测定反应前后装置和药品的总质量是最简便的实验操作;用排水法测定H2的体积增加实验操作收集时易损耗气体造成误差;反应结束后,过滤、洗涤、称量残渣的质量,需要过滤装置、天平称量等多部实验操作,增加操作仪器和步骤会对实验结果产生较多的误差,所以只有C是最简单的操作


科目:高中化学 来源:2014高考名师推荐化学微粒的组成、结构及性质(解析版) 题型:填空题
下表为部分短周期元素化合价及相应原子半径的数据:
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
最高化合价 | +6 | +5 | +4 |
| +5 |
| +7 | +4 |
最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
已知:
①A与D可形成化合物AD2、AD3;
②E与D可形成多种化合物,其中ED、ED2 是常见的化合物,C可用于制光电池。
(1)E在周期表中位置是 ;
(2)C和H的气态氢化物的稳定性强弱关系为 (用分子式表示);
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)工业上可用纯碱溶液处理ED和ED2,该反应如下:
ED+ED2+Na2CO3=2 +CO2
横线上某盐的化学式应为 。
(5)在一密闭容器中发生反应2AD2+D2 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量 (填“增加”“减少”或“不变”)其原因为 。
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量 (填“增加”“减少”或“不变”)其原因为 。
(6)请设计一个实验方案,使铜和稀的H2AD4溶液反应,得到蓝色溶液和氢气。绘出该实验方案装置图。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
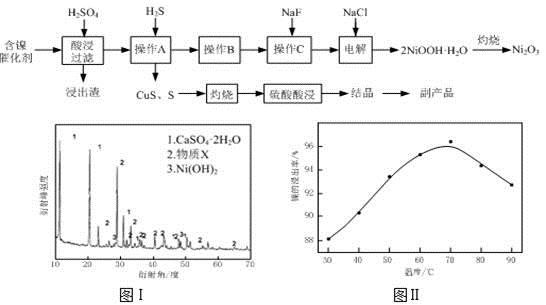
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下??验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价 (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验药品保存、基本操作、检验(解析版) 题型:选择题
下列关于仪器使用的说法正确的是
A.滴定管装滴定液时不应先用滴定液润洗
B.锥形瓶用作反应容器时一定不能加热
C.蒸馏时温度计水银球可以高于蒸馏瓶支管口
D.振荡分液漏斗时应关闭其玻璃塞和活塞
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:实验题
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
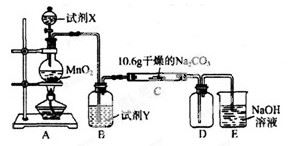
(1)写出装置A中发生反应的离子方程式: 。
(2)写出试剂Y的名称_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分:NaHCO3和__________
假设二:存在三种成分:NaHCO3和__________、__________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
步骤2:向A试管中滴加_________: | ①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
步骤3:向B试管中滴加________: | 若溶液变浑浊,结合步骤2中的①,则假设一成立:结合步骤2中的②,则假设二成立。 |
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH﹣)-c(H+)=____ (用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有___________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:实验题
S2C12是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组 拟设计实验制备少量的S2C12,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价 降低)。加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2C12,反应的化学方程式为:2S+Cl2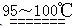 S2Cl2。
S2Cl2。
反应涉及的几种物质的熔沸点如下:
物质 | S | S2Cl2 |
沸点/℃ | 445 | 138 |
熔点/℃ | 113 | -76 |
该小组设计的制备装置如下图(夹持仪器已略去)
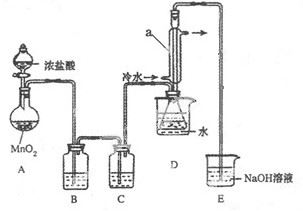
回答下列问题:
(1)连接好实验装置后的第一步实验操作是______。
(2)实验中需要加热的仪器是 (填写字母)
(3)装置B、C中的试剂分别是 。
(4)装置D中仪器a的作用是 。
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是____________。
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因____________。
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气体产生。用离子方程式表示产生该现象的原因____________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学守恒及离子浓度大小的比较(解析版) 题型:选择题
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.1 L 0.1 mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(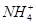 )+c(Fe2+)+c(H+)=c(OH-)+c(
)+c(Fe2+)+c(H+)=c(OH-)+c(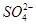 )
)
B.0.1 mol·L-1 NH4HS溶液中:c(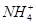 )=c(HS-)+c(H2S)+c(S2-)
)=c(HS-)+c(H2S)+c(S2-)
C.0.1 mol·L-1 pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(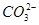 )=c(
)=c(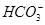 )+3c(H2CO3)+2c(H+)
)+3c(H2CO3)+2c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学周期表、核素(解析版) 题型:选择题
短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
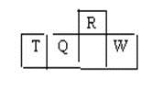
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学键与分之间作用力(解析版) 题型:选择题
下列各物质中,化学键类型完全相同的是
A.Na2O2和NaOH B.CH3COONa和NaOH
C.CCl4和H2O D.CO2和H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com