
| A. | CO2气体不能支持任何物质的燃烧 | |
| B. | 铝合金的硬度、熔点比组成合金各成分金属的大 | |
| C. | 将一小块钠放入足量AlCl3溶液中,最终有沉淀生成的 | |
| D. | 常温下,金属镁、铝在空气中都能与氧气反应,所以它们在空气中不能稳定存在 |
分析 A.Mg与二氧化碳可发生燃烧反应;
B.合金的硬度比各成分的低;
C.钠放入足量AlCl3溶液中,生成氢氧化铝沉淀;
D.Mg、Al均易被氧化.
解答 解:A.Mg与二氧化碳可发生燃烧反应,则可支持某些物质的燃烧,故A错误;
B.合金的硬度比各成分的低,而熔点比组成合金各成分金属的大,故B错误;
C.钠放入足量AlCl3溶液中,反应生成氯化钠、氢气、氢氧化铝,则最终生成氢氧化铝沉淀,故C正确;
D.Mg、Al均易被氧化,则常温下,金属镁、铝在空气中不能稳定存在,故D正确;
故选CD.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
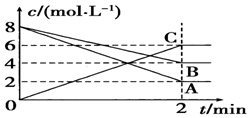 某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Ag+、NO${\;}_{3}^{-}$、Cl- | B. | Mg2+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Ba2+、K+、S2-、Cl- | D. | Fe2+、Na+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物就是我们所说的烃 | |
| B. | 这一发现可以为我们提供足够的化石燃料,从而减少开发新能源的投资 | |
| C. | 从石油中可以获得重要的有机化工原料--乙烯 | |
| D. | 相同质量的碳氢化合物中氢的质量分数越高,完全燃烧时消耗的O2越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
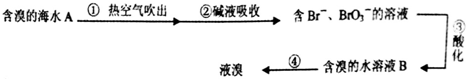
| A. | ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O=5Br-+BrO3-+6HCO3- | |
| B. | 第③步,需加人氧化性酸,才能将Br-氧化为Br2 | |
| C. | B溶液颜色要比A 溶液深 | |
| D. | 第④步,采用的是蒸馏的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com