
| A. | 1mol羟基(-OH)含有10NA个电子 | |
| B. | 在20gH218O中含有10NA个中子 | |
| C. | 标准状况下,22.4L四氯化碳含有NA个四氯化碳分子 | |
| D. | 1mol乙醇分子中含有共用电子对数目为7NA |
分析 A、羟基是中性基团,基团的电子等于基团中各元素的质子数和;
B、求出H218O的物质的量,氢原子无中子,由于一个H218O分子中含有10个中子,再根据N(中子数)=10n(H218O)NA计算;
C、气体摩尔体积vm=22.4L/mol的使用范围是单一气体或能共存的混合气体(在标准状况下);
D、依据乙醇结构分析计算共用电子对数.
解答 解:A、基都是中性基团,基团的电子等基团中各元素的质子数和,而1mol羟基(-OH)含有9NA个电子,故A错误;
B、在20gH218O中n(H218O)=$\frac{20g}{20g/mol}$=1mol,再根据N(中子数)=10n(H218O)NA=10×1×NA═10NA,故B正确;
C、标准状况下,四氯化碳是液态,不是气体,不能使用气体摩尔体积22.4L/mol,故C错误;
D、1mol乙醇分子中含有共用电子对数目为8NA,故D错误;
故选B.
点评 本题考查化学常用计量,难度不大,注意气体摩尔体积的使用范围和条件及重水的摩尔质量,标准状况下,四氯化碳是液态,不是气体.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
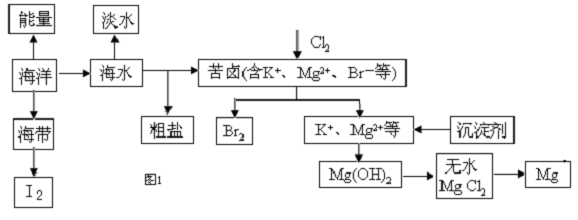
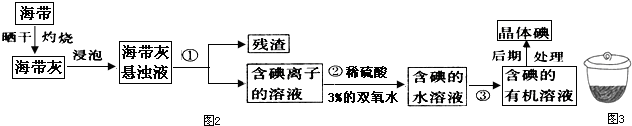

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C30H60 | B. | C30H56 | C. | C30H52 | D. | C30H50 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
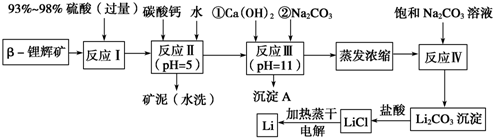
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol C3H6Cl2中化学键总数为NA | |
| B. | 42 g乙烯中含碳原子数为3 NA | |
| C. | 标准状况下,1L苯完全燃烧生成的气态产物的分子数为$\frac{6}{22.4}$NA | |
| D. | 0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com