
已知某离子晶体晶胞如下图所示,其摩尔质量为M,阿伏加德罗常数为NA,晶体的密度为d g/cm3。下列说法中正确的是
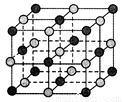
A. 晶体晶胞中阴、阳离子的个数都为1
B. 该晶体中两个距离最近的同种离子的核间距为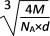 cm
cm
C. 其中阴、阳离子的配位数都是4
D. 该晶胞可能是NaCl的晶胞
科目:高中化学 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:选择题
某酸性燃料电池(以甲醇为燃料,酸性介质)结构示意如图。下列有关说法正确的是
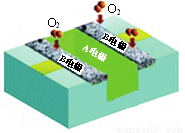
A. 电池工作时,电子由A电极经外电路流向B电极
B. 电池工作时,减少的化学能完全转化为电能
C. A电极发生的电极反应为:
CH3OH-6e-+H2O=CO2+6H+
D. B电极每消耗1 mol O2,电池中减少4 mol H+
查看答案和解析>>
科目:高中化学 来源:2017届湖北省八校高三第二次联考(3月)理综化学试卷(解析版) 题型:简答题
I、煤制天然气的工艺流程简图如下:
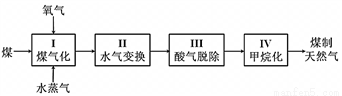
⑴反应I:C(s) + H2O(g) CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
⑵反应II:CO(g) + H2O(g)  CO2(g) + H2(g) ΔH = ?41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH = ?41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
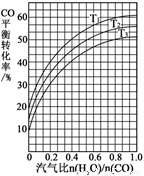
① 判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
② 若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是_______(填“T1”或“T2”或“T3”)。
⑶① 甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_______。
② 工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是_______。
II、利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g) 2H2O(g)+4CO(g)
2H2O(g)+4CO(g)  H>0
H>0
CH4超干重整CO2的催化转化原理示意如图:
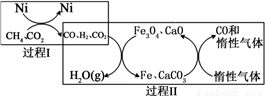
⑷过程II,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I和过程II中均含有氧化还原反应
b.过程II中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料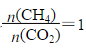 ,可导致过程II中催化剂失效
,可导致过程II中催化剂失效
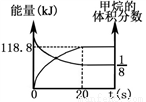
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g) 2H2O(g)+4CO(g)
2H2O(g)+4CO(g)  H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的
H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的 H=________________。
H=________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列有关杂化轨道的说法不正确的是
A. 原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道
B. 轨道数目杂化前后可以相等,也可以不等
C. 杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理
D. 杂化轨道可分为sp、sp2、sp3杂化等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
由短周期元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20。下列说法中正确的是
A. 晶体中阳离子和阴离子个数不一定相等
B. 晶体中一定有离子键不可能有共价键
C. 所含元素一定不在同一周期也不在第一周期
D. 晶体中阳离子半径一定大于阴离子半径
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )
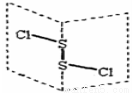
A.S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一3月月考化学试卷(解析版) 题型:选择题
中国科学技术名词审定委员会确定:111号元素(符号为Rg)的中文名称为“ ”。下列说法正确的是 ( )
”。下列说法正确的是 ( )
A. 111号元素是第6周期ⅠA族的金属元素 B. 111号元素属于过渡元素
C. 111号元素为非金属元素 D. 111号元素质量数为111
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高一3月月考化学试卷(解析版) 题型:选择题
.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( )
A. ⅢA族或ⅢB族 B. ⅣA族 C. ⅠB族 D. ⅠA族
查看答案和解析>>
科目:高中化学 来源:2017届山西省太原市高三模拟考试(一)理综化学试卷(解析版) 题型:填空题
乙苯是一种用途广泛的有机原料,可制备多种化工产品。
(一)制备苯乙烯(原理如反应I所示):
Ⅰ. 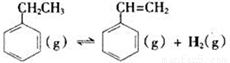 △H=+124kJ·mol-1
△H=+124kJ·mol-1
(1)部分化学键的键能如下表所示:
化学键 | C-H | C-C | C=C | H-H |
键能/ KJ/mol | 412 | 348 | X | 436 |
根据反应I的能量变化,计算X=_________。
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。请用化学平衡理论解释通入水蒸气的原因:_________。
(3)已知吉布斯自由能△G=△H-T△S ,当△G < 0时反应可自发进行。由此判断反应I在_________(填“高温”或“低温”)更易自发进行。
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ.  △H2>0
△H2>0
(4)T°C时,向10 L恒容密闭容器中充入2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、 α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:
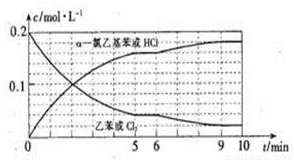
①0—2 min内,以HCl表示的该反应速率v(HCI)=_________。
②6 min时,改变的外界条件为_________,该条件下的平衡常数K的数值=_________。
③10 min时,保持其他条件不变,再向容器中充入1 mol乙苯、1 mol Cl2、1 molα-氯乙基苯和1mol HCl,则此时该反应v正_________v逆(填“>”、“<”或“=” );若12 min时反应再次达到平衡,则在0-12 min内,Cl2的转化率α=_________。(计算结果保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com