
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将1.00 mol·L-1 NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。
(1)计算室温时20.00 mL 1.00 mol·L-1的一元酸
HA的电离度α=________。
 (2)图中B点所示的溶液中所含各离子浓度由
(2)图中B点所示的溶液中所含各离子浓度由
大到小的顺序是_____。
(3)下列说法正确的是________(填相应序号)。
A.由图中可知NaOH和HA反应的ΔH>0
B.图中C点所加NaOH溶液的体积V=20.00 mL
C.图中C点时溶液的KW略大于1×10-14 mol·L-1,溶液中c(H+)=1×10-7 mol·L-1
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入
0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的
部分情况如图所示。]回答下列问题:
① 在同一溶液中,H2CO3、HCO 、CO
、CO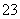
______(填“能”或“不能”)大量共存;
② 当pH=7时,溶液中含碳元素的主要微粒为________,溶液中各种离子的物质的量
浓度的大小关系为________________________________;
③ 已知在25 ℃时,CO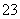 水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
水解反应的平衡常数即水解常数Kh=2×10-4 mol·L-1,当溶
液中c(HCO )∶c(CO
)∶c(CO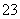 )=2∶1时,溶液的pH=________。
)=2∶1时,溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向一定体积0.1 mol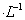 的氨水中逐滴滴加 0. 1mol
的氨水中逐滴滴加 0. 1mol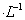 的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)] 的变化关系如右图所示,则下列说法中错误的是
的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)] 的变化关系如右图所示,则下列说法中错误的是
A.M点所示溶液中c( NH4+)>c(Cl-)
B.Q点所示溶液的导电熊力强于M点
C.Q点消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的电离程度相同

查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有Cl-和I-的物质的量浓度相同。为了氧化I-而不使Cl-氧化,试根据下列三个反应判断,可选用的氧化剂是( )
①2Fe3++2I-=2Fe2++I2②2Fe2++Cl2=2Fe3++2I-③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
A.FeCl2 B.KMnO4 C.浓盐酸 D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴按要求写出下列反应的离子方程式
①氢氧化铜 溶于盐酸
溶于盐酸 
②硫酸氢钠溶液中滴加纯碱溶液
⑵写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的两个化学方程式
①
②
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应先用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:

然后加入足量 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中 的体积分数为 。
的体积分数为 。
[探究二]
分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。

(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有 ,预计实验现象应是 。
,预计实验现象应是 。
(7)若要测定限定体积气体Y中 的含量(标准状况下约有28ml
的含量(标准状况下约有28ml ),除可用测量
),除可用测量 体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.依据丁达尔现象可将分散系分为溶液、胶体与浊液
B.二氧化硅的分子式是SiO2
C.单质硅是将太阳能转变为电能的常用材料
D.漂白粉和水玻璃长期暴露在空气中变质,能用同一原理解释
查看答案和解析>>
科目:高中化学 来源: 题型:
某亚硝酸钠生产厂采用硝酸为原料,其生产原理是NO+NO2+2NaOH===2NaNO2+H2O。工艺流程如下

(1)分解塔中填有大量的瓷环,其目的是:_____________________________。
(2)按一定计量比在反应塔中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则分解塔中发生反应的化学方程式为: ____________________________。试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因是_____________________________________,若硝酸浓度过高,吸收塔中可能发生的副反应化学方程式为_____________________________________________。
(3)通入一定量的N2的目的是: ___________________________________。
(4)吸收塔中尾气如何再利用:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e- == Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com