
为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,该试剂是 ( )。
A.NaOH B.Na2CO3
C.氨水 D.MgO
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
用A.质子数 B.中子数 C.核外电子数 D.最外层电子数 E.电子层数,填写下列空格。
(1)同位素种类由________决定;
(2)元素种类由________决定;
(3)元素有同位素由________决定;
(4)元素的化学性质主要由________决定;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C.用加热的方法可以除去KCl溶液中的Fe3+
D.洗涤油污常用热的碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①上述两种解释中________(填“甲”或“乙”)正确。
②为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
③若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。(已知25 ℃时CH3COONH4溶液呈中性)
(2)有甲、乙两同学做了如下实验:甲同学在制得的Mg(OH)2沉淀中加入浓的NH4Cl溶液,结果沉淀溶解;乙同学在制得的Mg(OH)2沉淀中加入浓CH3COONH4溶液,结果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:
甲同学的解释为:因为NH4Cl溶液中,NH +H2ONH3·H2O+H+,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
+H2ONH3·H2O+H+,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
乙同学的解释为:因为CH3COONH4===CH3COO-+NH ,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq),NH
,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq),NH +OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
+OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
你认为哪一位同学的解释是正确的?________,为什么?
__________________________________________________________________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如下:
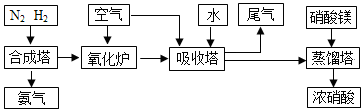
(1)简述原料气N2、H2的 。(2)下列可以代替硝酸镁加入到蒸馏塔中的是:
A.浓硫酸 B.氯化钙 C.氯化镁 D.生石灰
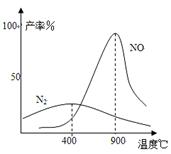
(3)氨气和氧气145℃就开始反应,在不同温度和催化剂时生成不同产物(如图所示):
4NH3+5O2 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
温度较低时以生成 为主,温度高于900℃时,
NO产率下降的原因 。
吸收塔中需要补充空气的原因 。
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NO和NO2的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2,请写出有关反应化学方程式:
, 。
查看答案和解析>>
科目:高中化学 来源: 题型:
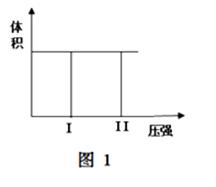
( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
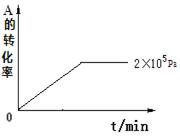
⑷其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是 ( )
| 编号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 强酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
A.①③ B.②③
C.①④ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com