
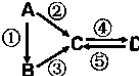
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:

 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
A、 浓硫酸稀释 |
B、 除去CO2中混有的杂质气体(HCl) |
C、 分离出AgNO3溶液中的AgCl |
D、 称量32.6g的NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、人体缺碘,可通过食用加碘盐补碘 |
| B、亚硝酸盐可常用作腌制肉类食品的防腐剂,大量进食易致癌 |
| C、维生素或钙、硒等不能添加在食品中 |
| D、缺铁性贫血,可通过食用铁强化酱油预防. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B(
.分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B(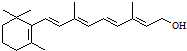 )和C.经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生
)和C.经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生
| 还原 |
| ①NaCN |
| ②H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 选项 | 甲 | 乙 | 丙 |
| A | AlCl3 | NH3?H2O | NaAlO2 |
| B | NaOH | (NH4)2SO3 | H2SO4 |
| C | SiO2 | NaOH | HF |
| D | CO2 | Ca(OH)2 | Na2CO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定同时含有三种金属杂质 |
| B、一定不含有杂质铜 |
| C、一定含有杂质镁 |
| D、可能同时含有杂质镁、铝或其中一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| A、△H1<0,△H3>0 |
| B、△H5<0,△H4<△H3 |
| C、△H1=△H2+△H3 |
| D、△H3=△H4+△H5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com