
分析 (1)NaHCO3会分解,生成Na2CO3,H2O和CO2,生成的Na2CO3与SiO2在高温下反应生成Na2SiO3和CO2,综合以上看整个反应过程,根据差量法确定混合物中SiO2的量;
(2)混合物中只有NaHCO3能与盐酸反应,根据第(1)题中得到的混合物中的混合物比例关系,结合反应关系确定盐酸的浓度,继而确定盐酸的pH.
解答 解:(1)混合物为NaHCO3和SiO2,在较高温度下,NaHCO3NaHCO3分解,发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,高温下,Na2CO3与SiO2发生反应:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,综合以上过程,发生的总反应为:2NaHCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+H2O+2CO2↑△m=106,
分情况讨论,若原混合物中SiO2过量,则反应按NaHCO3完全反应计算,因此原混合物中NaHCO3的质量为$\frac{(14.4g-9.1g)×2×84}{106}=8.4g$,则原混合物中SiO2的质量为14.4g-8.4g=6g,剩余的9.1g应为反应剩余的SiO2和反应生成的Na2SiO3,再经过加热质量不会改变;
若原混合物中NaHCO3过量,则反应按SiO2完全反应计算,因此原混合物中SiO2的质量为$\frac{(14.4g-9.1g)×60}{106}=3g$,此时反应相当于进行了到了反应产物为Na2SiO3和NaHCO3,若继续加热,NaHCO3还会分解,因此剩余质量不再是9.1g,这种情况不成立,舍去.
故答案为:6.
(2)另取1.44g混合物与100mL盐酸恰好反应,混合物中只有NaHCO3能与盐酸反应,反应为:$HC{O}_{3}^{-}+{H}^{+}=C{O}_{2}↑+{H}_{2}O$,溶液呈中性,二者恰好按1:1完全反应,并且假设CO2完全逸出,原混合物中每14.4g的混合物中,SiO2的含有6g,NaHCO3含有8.4g,当取1.44g这样的混合物时,其中含有NaHCO3的质量应为0.84g,则$n(HC{O}_{3}^{-})=\frac{0.84g}{84g/mol}=0.01mol$,则根据反应关系,100mL盐酸中,$n({H}^{+})=n(HC{O}_{3}^{-})=0.01mol$,则$c({H}^{+})=\frac{0.01mol}{0.1L}=0.1mol/L$,所以盐酸的pH=-lgc(H+)=1.故答案为:1.
点评 本题主要考察化学反应方程式的计算,需思考到混合物中反应的过量问题,并分类讨论,题目难度中等,是中档题.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题



 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
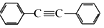 以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:
以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如图:
 ,B的官能团名称为羰基.
,B的官能团名称为羰基. .
. .
. 或
或 .
. 的合成路线:
的合成路线: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=4的氯化铵溶液中:c(H+)=c(NH3•H2O )=1×10-4mol•L-1 | |
| B. | pH相同的①NaOH、②NaClO两种溶液中水的电离程度:①<② | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1KHS溶液中:c(K+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | |
| B. | 常温下,0.1 mol/L 的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,其中c(NH4+)由大到小的顺序是:①>②>③ | |
| C. | 在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时 间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过渡元素中寻找优良的催化剂 | |
| B. | 由元素周期律HC1O4可以类推出氟元素也存在最高价氧化物的水化物HFO4 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 在化工生产中应遵循“绿色化学”的思想 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com