
| A. | 只有①② | B. | 只有①②④有尽有 | C. | 只有①②③ | D. | 全部 |
分析 胶体具有的性质有:丁达尔效应;聚沉;电泳,胶体粒度介于1nm-100nm之间,不能透过半透膜,依据胶体的性质分析解答.
解答 解:胶体具有的性质有丁达尔效应;聚沉;电泳.胶体粒度介于1nm-100nm之间,不能透过半透膜.
①用盐卤点豆腐是胶体的聚沉的应用,与胶体性质有关;
②血液属于胶体,医学上微波手术是利用胶体聚沉的性质,微波手术能大大减少病人出血量与胶体性质有关;
③明矾溶于水形成氢氧化铝胶体具有较大的表面积,能吸附水中的不溶性固体杂质,是常用的净水剂,用明矾净水与胶体的性质有关;
④江河入海口形成三角洲的形成是胶体聚沉的作用,与胶体性质有关;
故选:D.
点评 本题主要考查了胶体的性质,及胶体想性质在实际生产生活中的应用,题目难度不大,胶体的本质特征是分散质的粒度介于1nm-100nm之间.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
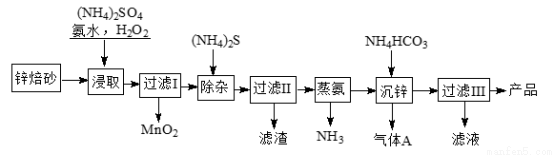
请回答下列问题:
(1)当(NH4)2SO4、NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42?)时,溶液呈 (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写两种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2?能将Cu2+硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36;一般认为反应的平衡常数K>105,该反应进行基本完全。]
(5)“沉锌”的离子方程式为___________________。
(6)上述流程中多次需要过滤,实验室进行过滤操作需要用到的玻璃仪器有__________。“过滤III”所得滤液可循环使用,产品需洗涤干燥后备用,检验产品洗涤干净的操作和现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
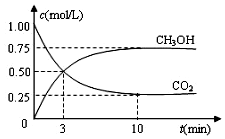 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ Cl- SO42- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ Na+ Cl- Cu2+ | D. | Na+Ba2+OH- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示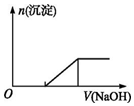 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com