

| ||
| ||


科目:高中化学 来源: 题型:
| A、三种金属常温下均不溶于足量的浓硝酸中 |
| B、三种金属久置于潮湿的空气中均能生成氧化物而生锈 |
| C、三种金属均能与硫反应,分别生成Cu2S、Al2S3、FeS |
| D、三种金属的还原性:Al>Fe>Cu;离子的氧化性:Cu2+>Fe3+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
| B. | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
| C. | 苯 | 苯酚 | 浓溴水 | 过滤 |
| D. | 苯 | 甲苯 | KMnO4(酸化),NaOH溶液 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
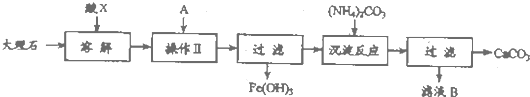
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.8 g |
| B、8.8 g |
| C、9.6g |
| D、14.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 丁 |
| 丁 |
| 甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol?L-1HF溶液与0.1mol?L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(F-)-c(HF) |
| B、0.1mol?L-1KHCO3溶液中:c(CO32-)+c(OH-)=c(H+)+2c(H2CO3) |
| C、pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH+)>c(OH-)=c(H+) |
| D、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、G点时沉淀的质量为18.5g |
| B、该混合溶液中6c(Fe3+)>c(NO3-) |
| C、该混合溶液在空气中加热、蒸干、灼烧后所得到的固体为Fe(NO3)3和Al(NO3)3 |
| D、室温下Ksp[Al(OH)3]>Ksp[Fe(OH)3] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com