
(10��)ij�ϳ���֬E�ĵ���A��C3H4O2������������ת����ϵ��
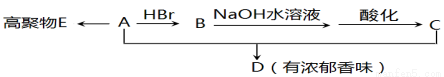
��֪���� A��ʹ���CCl4��Һ��ɫ��������̼������Һ��Ӧ�ų�CO2
��  ��
��  ��Xָ±��ԭ�ӣ�
��Xָ±��ԭ�ӣ�
�ش��������⣺
��1��A�й����ŵ������� ��
��2��A+C��D�Ļ�ѧ����ʽ ��
��3��E�Ľṹ��ʽ ��
��4�����л�����������B��ͬ���칹����� ��
A��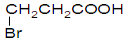 B��
B��
C��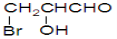 D��
D��
��5�����ڻ�����D������˵����ȷ���� ��
A���ܷ���ˮ�ⷴӦ B���������ᷢ��������Ӧ
C������ʹ����KMnO4��Һ��ɫ D������������Ʒ�Ӧ�ų�����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶���ѧ�ڵ�һ�ζ��п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���0.100 mol��L-1NaOH��Һ�ֱ�ζ�20.00 mL 0.100 mol��L-1������ʹ��ᣬ�ζ�������ͼ��ʾ������˵����ȷ����
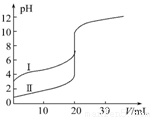
A�����ʾ���ǵζ����������
B��pH=7ʱ���ζ���������V��NaOH)С��20 mL
C��V��NaOH)=20.00 mLʱ��������Һ��c��Cl-)=c��CH3COO-)
D��V��NaOH)=10.00 mLʱ��������Һ��:c��Na+)>c��CH3COO-)>c��H+)>c��OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ��10��������ѧ�Ծ��������棩 ���ͣ�ѡ����
Na2FeO4��һ������ˮ������������ͨ�����з�Ӧ��ȡ��ʪ���Ʊ�����Ҫ��Ӧ����Ϊ��2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O���ɷ��Ʊ�����Ҫ��Ӧ����Ϊ��2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
�����йظ÷�Ӧ��˵����������
A������Ӧ��Na2FeO4��Ϊ��������
B��Na2FeO4��ǿ�����ԣ�������ɱ�����仹ԭ����������ˮ������
C���ɷ���ÿ����1mol Na2FeO4ת��3mol����
D�����������£�NaClO�����Դ���Na2FeO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��ʯ�и߶���ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��Ӧ��A(��)��3B(��)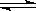 2C(��)�� ��H < 0 ��ƽ�������������¶Ƚ��ͣ�������������ȷ����
2C(��)�� ��H < 0 ��ƽ�������������¶Ƚ��ͣ�������������ȷ����
A������Ӧ���ʼӴ��淴Ӧ���ʱ�С��ƽ��������Ӧ�����ƶ�
B������Ӧ���ʱ�С���淴Ӧ���ʼӴ�ƽ�����淴Ӧ�����ƶ�
C������Ӧ���ʺ��淴Ӧ���ʶ���С��ƽ��������Ӧ�����ƶ�
D������Ӧ���ʺ��淴Ӧ���ʶ���С��ƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�����и�����ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£������������Ϊ2.0 L�ĺ����ܱ������з������·�Ӧ��PCl5(g) PCl3(g)��Cl2(g)
PCl3(g)��Cl2(g)
��� | �¶ȣ��棩 | ��ʼ���ʵ��� ��mol�� | ƽ�����ʵ��� ��mol�� | �ﵽƽ������ʱ�� ��s�� | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
�� | 320 | 0.40 | 0.10 | 0.10 | t1 |
�� | 320 | 0.80 | t2 | ||
�� | 410 | 0.40 | 0.15 | 0.15 | t3 |
����˵����ȷ����
A��ƽ�ⳣ��K��������>������
B����Ӧ����ƽ��ʱ��PCl5��ת���ʣ�������<������
C����Ӧ����ƽ��ʱ������I�е�ƽ������Ϊv(PCl5)= 0.10/t1 mol/(L��s)
D����ʼʱ���������г���PCl5 0.30 mol��PCl3 0.45 mol��Cl2 0.10 mol����Ӧ�����淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�����и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
(14��)��ش��������⣺
��1���±��г���һЩ��ѧ���ļ���E��
��ѧ�� | H��H | O===O | O��H |
E/kJ��mol��1 | 436 | x | 463 |
��ӦH2(g)�� O2(g)===H2O(g) ��H����241.8 kJ��mol��1����x��__________��
O2(g)===H2O(g) ��H����241.8 kJ��mol��1����x��__________��
��2��Ǧ�������������ϸ�����PbO2���������ϸ�����Pb���������Һ��H2SO4��Һ����طŵ�ʱ���ܷ�Ӧ��Pb+PbO2+2H2SO4=2PbSO4+2H2O��
��д�����ʱ�����ĵ缫��Ӧʽ��__________________
��3����Ӧm A��n B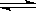 p C����ij�¶��´ﵽƽ�⡣
p C����ij�¶��´ﵽƽ�⡣
����A��B��C�������壬��ѹ������Ӧ����С���淴Ӧ���ʣ���m��n��p�Ĺ�ϵ��________________��
����CΪ���壬��m + n = p���ڼ�ѹʱ��ѧƽ�ⷢ���ƶ�����ƽ��ض���________________�����ƶ���
�����������¶ȣ�ƽ���������ƶ���������ӦΪ _________ ��Ӧ������ȡ����ȡ���
��4������������ԭ��ӦZn(s)��Cu2��(aq)===Zn2��(aq)��Cu(s)��Ƶ�ԭ�����ͼ��ʾ��
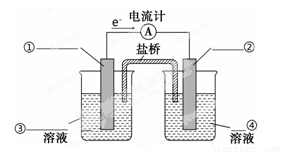
������ͼ�б���缫���ϼ��������Һ��д��ѧʽ��________________
�������е�Cl����________���ƶ�������ҡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���б仯��������������ԭ�����͵���
A������ɫ��NO2�����ѹ����ɫ�ȱ����ٱ�dz
B��H2��I2��HI��������ѹ����ɫ����
C����������ת��Ϊ��������ʱ���ӿ�����������߶��������ת����
D������ˮƿ�������д����������ݳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
14�֣�����һ����Ҫ�ķǽ���Ԫ�أ������γɶ��ֲ�ͬ���͵Ļ���������Ҫ��ش� �������⣺
�������⣺
��1��NA�� ʾ�����ӵ���������ֵ��69g NO2��N2O4�Ļ�������к���____________NA����ԭ�ӣ�2L 0.6 mol/LFe(NO3)3��Һ�к�________NA��NO3-���ӡ�
ʾ�����ӵ���������ֵ��69g NO2��N2O4�Ļ�������к���____________NA����ԭ�ӣ�2L 0.6 mol/LFe(NO3)3��Һ�к�________NA��NO3-���ӡ�
��2����������(NF3)��һ����ɫ����ζ�����壬�������ӹ�ҵ�����Ĺؼ�ԭ��֮һ�����������ڳ�ʪ�Ŀ�������ˮ�����ܷ���������ԭ��Ӧ���䷴Ӧ�IJ����У�HF��NO��HNO3��
��д���÷�Ӧ�Ļ�ѧ����ʽ ����Ӧ������0.15 mol HNO3��ת�Ƶĵ�����ĿΪ________����
�������������ɰ����ͷ�����Ӧ�õ���4NH3+3F2=NF3+3NH4F���������Ʋ�NF3��F2��NO���������У���������ǿ������˳��Ϊ________________________
��NF3��һ����ɫ���������壬һ��NF3й©��������NaOH��Һ���ܵķ���������Ⱦ��������NaNO2��NaF��H2O�⣬���϶���___________________(�ѧʽ)��
��3������������N2H4���ǵ������ֳ���������Ʊ��������ñ�ͪΪ�� �����������������백����Ӧ���÷�Ӧ�л�ԭ���������������ʵ���֮��Ϊ2:1��д���÷�Ӧ�Ļ�ѧ����ʽ ��
�����������������백����Ӧ���÷�Ӧ�л�ԭ���������������ʵ���֮��Ϊ2:1��д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ��һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��������ֲ�У�����0.5 mol��L��1 NH4Cl��0.16 mol��L��1 KCl��0.24 mol��L��1 K2SO4��Ӫ��Һ������KCl��NH4Cl����NH4��2SO4���ֹ�������1 LӪ��Һ����������ֹ�������ʵ���Ϊ
A��0.4 mol 0.5 mol 0.12 mol
B��0.64 mol 0.02 mol 0.24 mol
C��0.64 mol 0.5 mol 0.24 mol
D��0.66 mol 0.5 mol 0.24 mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com