
分析 ①明矾净水是利用铝离子水解生成的氢氧化铝胶体具有吸附悬浮杂质的作用净水;
②pH<5.6的雨水称为酸雨;石灰石的主要成分是碳酸钙,吸收SO2生成CaSO4;氨气、二氧化碳、水反应生成碳酸氢铵;根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答,根据信息“CO和H2在加热和催化剂条件下反应,可以制得液体燃料甲醇(CH3OH)”写出化学反应式;
③劣质胶合板释放的主要污染物是甲醛,释放后造成室内污染.
解答 解:①明矾是硫酸铝钾的晶体,净水作用是利用其溶解后的溶液中,铝离子水解生成的氢氧化铝胶体具有吸附悬浮杂质的作用,所以用来净水,属于混凝法;
故答案为:a;
②pH<5.6的雨水称为酸雨,石灰石的主要成分是碳酸钙,吸收SO2生成CaSO4,配平得反应的化学方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2↑;氨气、二氧化碳、水反应生成碳酸氢铵:CO2+H2O+NH3=NH4HCO3;尿素的相对分子质量为60,尿素中氮元素的质量分数是$\frac{14×2}{60}$×100%≈46.7%;
碳铵的相对分子质量为:$\frac{14}{79}$×100%=17.7%;
所以氮元素的质量分数较高的是尿素,CO和H2在加热和催化剂条件下反应,可以制得液体燃料甲醇(CH3OH),故方程式为:[CO(NH2)2]CO+2H2=CH3OH,故答案为:5.6;2CaCO3+2SO2+O2═2CaSO4+2CO2;CO2+H2O+NH3=NH4HCO3;尿素;[CO(NH2)2]CO+2H2=CH3OH;
③甲醛是劣质胶合板释放的主要污染物,造成室内污染,故答案为:甲醛.
点评 本题考查环境污染及治理,为高频考点,侧重于化学与生活、生产、能源与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均 值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O也生成AlO2- | |
| B. | Mg可以常温下被氧气氧化,Al也可以常温下被氧气氧化 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Fe与S能反应生成FeS,则Cu与S也能反应生成CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 以石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | FeSO4溶液与稀H2SO4溶液、双氧水混合:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 最多能与8molNaOH发生反应 最多能与8molNaOH发生反应 | |
| B. | 甲苯既能跟溴水反应又能跟酸性高锰酸钾溶液反应 | |
| C. | 向苯酚钠溶液中通入少量的CO2气体,发生反应的离子方程式为: 2 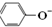 +H2O+CO2→2 +H2O+CO2→2 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 1mol 最多能和4molH2发生反应 最多能和4molH2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com