
| A. | Al(OH)3可以用来做胃酸中和剂 | |
| B. | 铝与任何酸、碱都能反应放出氢气 | |
| C. | 不宜用铝制品来蒸煮酸性或碱性食物 | |
| D. | Al2O3可以用来制造耐火坩埚、耐火管等实验仪器 |
分析 A.Al(OH)3可与胃酸成分盐酸反应;
B.铝与酸、强碱都能反应放出氢气;
B.Al与酸碱均反应;
D.Al2O3的熔点较高.
解答 解:A.Al(OH)3可与盐酸反应,胃酸中含盐酸,则Al(OH)3可以用来做胃酸中和剂,故A正确;
B.铝排在H的前边,与酸反应放出氢气,但是只能和强碱反应放出氢气,故B错误;
C.Al与酸碱均反应,在盐溶液中可发生电化学腐蚀,则不能用铝制品来蒸煮酸性、碱性或咸的食物,故C正确;
D.Al2O3的熔点较高,则Al2O3可以用来制造耐火坩埚、耐火管等实验仪器,故D正确;
故选B.
点评 本题考查Al及其化合物的性质,把握Al、氢氧化铝的化学性质及金属材料的使用为解答的关键,注意金属活泼性与金属使用历史的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
| X | Z | ||
| W | Y | R | |
 B.
B.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 要 求 | 试剂及方法 |
| 除去Na2CO3固体中少量NaHCO3 | |
| 除去铁中少量铝 | |
| 除去铜中少量铁 | |
| FeCl3溶液中混有少量FeCl2 | |
| 证明NH4Cl溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
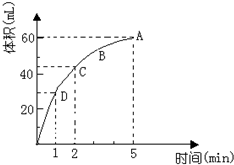 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | t/min c/(mol•L-1) 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.50 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com