
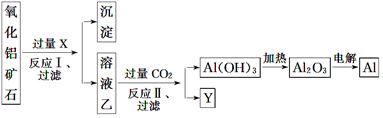
分析 溶液乙通入过量Y可生成Al(OH)3,说明试剂X用于分离Al2O3、Fe2O3,则试剂X是氢氧化钠溶液,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,所以过滤后所得溶液乙为NaAlO2溶液,沉淀为Fe2O3;
向偏铝酸钠溶液中通入过量Y为CO2,向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;生成Al(OH)3,Y为NaHCO3溶液,灼烧Al(OH)3得Al2O3,电解熔融Al2O3得到Al,以此解答该题.
解答 解:(1)溶液乙通入过量Y可生成Al(OH)3,说明试剂X用于分离Al2O3、Fe2O3,则试剂X是氢氧化钠溶液,Al2O3可用于冶炼金属铝或用作耐火材料;
故答案为:NaOH;可用于冶炼金属铝或用作耐火材料;
(2)反应 I为氧化铝与氢氧化钠反应,离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)反应II为偏铝酸钠和二氧化碳的反应,该反应的方程式:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(4)在高温下Al能与磁性氧化铁发生置换反应,生成氧化铝和铁,反应物为:9Al+3 Fe3O4 $\frac{\underline{\;高温\;}}{\;}$9 Fe+4Al2O3;
故答案为:9Al+3 Fe3O4 $\frac{\underline{\;高温\;}}{\;}$9 Fe+4Al2O3;
(5)向溶液乙中通入过量的CO2后需要过滤、洗涤,方可得到不含杂质(水分除外)的Al(OH)3,洗涤沉淀的方法是将沉淀置于过滤器中(或向漏斗中),加蒸馏水至刚好浸没沉淀,待水流尽,重复2~3次;过滤需要的玻璃仪器有漏斗、玻璃棒、烧杯;
故答案为:将沉淀置于过滤器中(或向漏斗中),加蒸馏水至刚好浸没沉淀,待水流尽,重复2~3次;漏斗、玻璃棒、烧杯.
点评 本题考查混合物分离提纯方法的选择和应用,为高频考点,把握混合物分离流程及发生的反应为解答的关键,侧重物质性质及分离方法的考查,明确物质性质差异性即可提纯分离物质,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
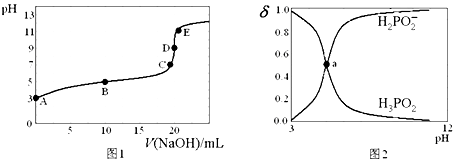
| A. | H3PO2的电离方程式为H3PO2?H2PO2-+H+ Ka≈10-5 | |
| B. | B点时,溶液中存在关系:2c(H+)+c(H2PO2-)═2c(OH-)+c(H3PO2) | |
| C. | C点时,溶液中存在关系:c(Na+)+c(H+)═c(H2PO2-)+c(OH-) | |
| D. | D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 56gN2与CO混合物中原子总数是4NA | |
| C. | 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA | |
| D. | 常温下,1LpH=l的H2SO4溶液中的H+为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
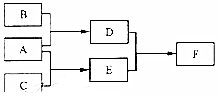 X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )
X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期,下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物,下列分析正确的是( )| A. | 离子半径:Y>Z | B. | Z的含氧酸均为强酸 | ||
| C. | 与Y同周期氰化物中D最稳定 | D. | F含离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
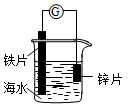
| A. | 锌片发生氧化反应作阴极 | |
| B. | 电子从铁片经过导线流向锌片 | |
| C. | 铁片上电极反应为:O2+2H2O+4e→4OH- | |
| D. | 该装置可用于研究外加电流阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com