
·ÖĪö Na2O2µÄµē×ÓŹ½ĪŖ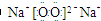 £¬æÉÓėĖ®¼°CO2·“Ó¦£¬·“Ó¦µÄ·½³ĢŹ½·Ö±šĪŖ2Na2O2+2CO2=2Na2CO3+O2£¬2Na2O2+2H2O=4NaOH+O2”ü£¬ŅŌ“Ė½ā“š£®
£¬æÉÓėĖ®¼°CO2·“Ó¦£¬·“Ó¦µÄ·½³ĢŹ½·Ö±šĪŖ2Na2O2+2CO2=2Na2CO3+O2£¬2Na2O2+2H2O=4NaOH+O2”ü£¬ŅŌ“Ė½ā“š£®
½ā“š ½ā£ŗA£®Na2O2µÄµē×ÓŹ½ĪŖ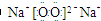 £¬¹ŹŅõ”¢ŃōĄė×ÓµÄøöŹż±ČĪŖ1£ŗ2£¬¹ŹA“ķĪó£»
£¬¹ŹŅõ”¢ŃōĄė×ÓµÄøöŹż±ČĪŖ1£ŗ2£¬¹ŹA“ķĪó£»
B£®Éś³ÉĻąĶ¬ĮæµÄO2Ź±ĻūŗĵÄĖ®ŗĶ¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæĻąĶ¬£¬µ«ÖŹĮæ²»Ķ¬£¬¹ŹB“ķĪó£»
C£®ŅŃÖŖ·“Ó¦µÄ¹ŲĻµŹ½£ŗH2”«H2O”«2NaOH”«Na2O2•H2£¬CO”«CO2”«Na2CO3”«Na2O2•CO£¬
ÓŠ»śĪļŌŚ×ćĮæŃõĘųÖŠČ¼ÉÕÉś³ÉCO2ŗĶH2O£¬ÓėNa2O2·¢Éś·“Ó¦£ŗ2Na2O2+CO2=2Na2CO3+O2”ü£¬
2Na2O2+2H2O=4NaOH+O2”ü£¬
¶ŌÉś³ÉĪļ±äŹ½£ŗNa2CO3”«Na2O2•CO£¬2NaOH”«Na2O2•H2£¬
ŌņÓŠ»śĪļÓ¦æɲšŠ“³É£ØCO£©m•HnµÄŠĪŹ½£¬
ŌņH2”¢COŅŌ¼°æɲšŠ“³É£ØCO£©m•HnµÄŠĪŹ½µÄÓŠ»śĪļÄÜĀś×ćÉĻŹö½į¹ū£¬
C6H12O6æɲšŠ“³É£ØCO£©6•H12£¬¹ŹCÕżČ·£»
D£®Na2O2Ņņ¾ßÓŠĒæŃõ»ÆŠŌ¶ųÓŠĘư׊Ō£¬SO2Ņ×ÓėÓŠÉ«ĪļÖŹ»ÆŗĻÉś³ÉĪŽÉ«²»ĪČ¶ØµÄĪļÖŹ£¬¹ŹŌĄķ²»Ķ¬£¬¹ŹD“ķĪó£»
E£®Na2O2ÓėĖ®·“Ó¦£¬Na2O2¼ČŹĒŃõ»Æ¼Į£¬ÓÖŹĒ»¹Ō¼Į£¬¹ŹE“ķĪó£»
F£®Éę¼°µÄ»Æѧ·½³ĢŹ½ÓŠ£ŗ¢Ł2NaHCO3$\frac{\underline{\;¼ÓČČ\;}}{\;}$Na2CO3+H2O+CO2”ü£¬¢Ś2CO2+2Na2O2ØT2Na2CO3+O2”ü£¬¢Ū2H2O+2Na2O2ØT4NaOH+O2”ü£¬¢Ü2NaOH+CO2ØTNa2CO3+H2O£¬
ÉčNa2O2”¢NaHCO3ĪŖ2mol£¬ŌņÉś³É1mol¶žŃõ»ÆĢ¼ŗĶ1molĖ®£¬Óė¹żŃõ»ÆÄĘĶźČ«·“Ó¦£¬Éś³É2molĢ¼ĖįÄĘŗĶ2molĒāŃõ»ÆÄĘ£¬ŌņĖłµĆ¹ĢĢåÖŠNa2CO3ŗĶNaOHµÄĪļÖŹµÄĮæÖ®±ČŅąĪŖ1£ŗ1£¬¹ŹFÕżČ·£®
¹Ź“š°øĪŖ£ŗCF£®
µćĘĄ ±¾Ģāæ¼²é¹żŃõ»ÆÄʵĊŌÖŹ£¬ĪŖøßæ¼øßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜ»ł“”ÖŖŹ¶µÄ×ŪŗĻŌĖÓĆ£¬×¢Ņā°ŃĪÕ·“Ó¦µÄ»Æѧ·½³ĢŹ½£¬øł¾Ż·½³ĢŹ½æɽā“šøĆĢā£¬ÄŃ¶Č²»“ó£®


 µ¼Ń§Č«³ĢĮ·““ÓÅѵĮ·ĻµĮŠ“š°ø
µ¼Ń§Č«³ĢĮ·““ÓÅѵĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓČėĻ”ŃĪĖį²śÉśĪŽÉ«ĪŽĪ¶ĘųĢ壬½«ĘųĢåĶØČė³ĪĒåŹÆ»ŅĖ®ÖŠ£¬ČÜŅŗ±ä»ė×Ē£¬ŌņČÜŅŗÖŠÓŠCO${\;}_{3}^{2-}$ | |
| B£® | ¼ÓČėĀČ»Æ±µČÜŅŗÓŠ°×É«³Įµķ²śÉś£¬ŌŁ¼ÓŃĪĖį£¬³Įµķ²»ĻūŹ§£¬Ņ»¶ØÓŠSO${\;}_{4}^{2-}$ | |
| C£® | ¼ÓČėĻõĖįĖį»ÆµÄĻõĖįŅųČÜŅŗÓŠ°×É«³ĮµķÉś³É£¬ŌņČÜŅŗÖŠŅ»¶Øŗ¬ÓŠCl- | |
| D£® | ČēĶø¹żĄ¶É«µÄīܲ£Į§Äܹ»¹Ū²ģµ½×ĻÉ«»šŃę£¬ŌņŅ»¶ØÓŠ¼ŲŌŖĖŲ£¬Ņ»¶Ø²»ŗ¬ÓŠÄĘŌŖĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1mol N2ÖŠŗ¬ÓŠµÄµē×ÓŹżĪŖ2NA | |
| B£® | ±ź×¼×“Ģ¬ĻĀ£¬1molĖ®Ėłŗ¬µÄŃõŌ×ÓŹżĪŖ1NA | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬17g°±ĘųĖłŗ¬µÄ·Ö×ÓŹż“óÓŚNA | |
| D£® | 2gĒāĘųĖłŗ¬µÄĒāŌ×ÓŹżĪŖNA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČ»Æļ§”¢“ĪĀČĖįÄĘ”¢“×Ėįļ§”¢ĮņĖį±µ¶¼ŹĒĒæµē½āÖŹ | |
| B£® | µē½ā”¢µēÓ¾”¢µēĄė”¢µē»ÆѧøÆŹ“¾łŠčŌŚĶصēĢõ¼žĻĀ²ÅÄܽųŠŠ | |
| C£® | ŗģ±¦ŹÆ”¢Ė®¾§”¢×źŹÆµÄÖ÷ŅŖ³É·Ö¶¼ŹĒ¶žŃõ»Æ¹č | |
| D£® | ø£¶ūĀķĮÖ”¢Ė®²£Į§”¢°±Ė®”¢µØ·Æ¾łĪŖ»ģŗĻĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  æÉ“ÓĀČ»ÆĢśČÜŅŗÖŠÖ±½ÓÕō·¢½į¾§»ńµĆĀČ»ÆĢś¾§Ģå æÉ“ÓĀČ»ÆĢśČÜŅŗÖŠÖ±½ÓÕō·¢½į¾§»ńµĆĀČ»ÆĢś¾§Ģå | |
| B£® |  æÉ·ÖĄėŹÆÓĶ£¬µĆµ½ĘūÓĶ”¢ĆŗÓĶŗĶ²ńÓĶµČø÷ÖÖĮó·Ö æÉ·ÖĄėŹÆÓĶ£¬µĆµ½ĘūÓĶ”¢ĆŗÓĶŗĶ²ńÓĶµČø÷ÖÖĮó·Ö | |
| C£® |  ĄūÓĆ“ĖĶ¼·ÖĄėCH3CH2OHŗĶCH3COOC2H5»ģŗĻŅŗ ĄūÓĆ“ĖĶ¼·ÖĄėCH3CH2OHŗĶCH3COOC2H5»ģŗĻŅŗ | |
| D£® |  æɽųŠŠĖį¼īÖŠŗĶµĪ¶Ø æɽųŠŠĖį¼īÖŠŗĶµĪ¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com