
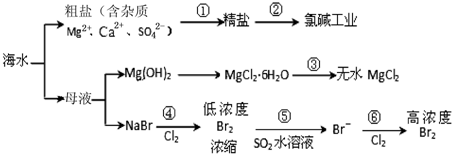
| A. | 除去粗盐中杂质(Mg2+、Ca2+、SO42-),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 | |
| D. | 从第④步到第⑥步的目的是为了浓缩富集溴 |
分析 海水蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠;母液加氢氧化钠反应生成氢氧化镁沉淀,氢氧化镁和酸反应生成氯化镁,制得氯化镁,母液通入氯气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质得到高浓度的溴.
A.先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子,盐酸要放在最后;
B.氯化镁中镁离子会水解,生成氢氧化镁以及氯化氢,据氯化氢的挥发性进行分析;
C.根据化学方程式系数之比等于物质的量之比来分析;
D.溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素.
解答 解:A.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可以先加入过量的氢氧化钠溶液除去镁离子,再加入过量的氯化钡溶液除去硫酸根离子,然后加入过量的碳酸钠溶液除去钙离子和多余的氯化钡,过滤将生成的沉淀除去,此时溶液中含有过量的氢氧化钠溶液和碳酸钠溶液,可以加入适量的盐酸,调节呈中性,故A错误;
B.因MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,若要由MgCl2•6H2O灼烧即可制得无水MgCl2,为防止Mg2+发生水解,应在HCl气氛中进行,故B错误;
C.因 2Br-+Cl2 =Br2 +2Cl-,每氧化0.2molBr-需消耗0.1molCl2,0.1molCl2的体积标准状况为2.24L,在其他状况下不一定为2.24L,故C错误;
D.第④步溴离子被氯气氧化为溴单质后,第⑤步被二氧化硫吸收生成溴离子,第⑥步通入氧化剂氯气氧化溴离子为溴单质,富集溴元素,从第④步到第⑥步的目的是为了浓缩富集溴,故D正确;
故选D.
点评 本题考查了海水资源综合利用,涉及了离子的除杂、离子水解、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性,本题难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
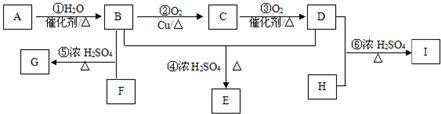
 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | N2 | NO | NO2 |
| B | S | SO2 | SO3 |
| C | Si | SiO2 | H2SiO3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
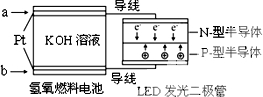 LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | 该装置将化学能最终转化为电能 | |
| B. | a处通入O2 | |
| C. | b处为电池正极,发生还原反应 | |
| D. | 通入O2的电极上发生的电极反应为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1CaCl2溶液中含氯离子数为0.2 NA | |
| B. | 0.1 mol铁粉与过量的氯气完全反应,转移电子数为0.2NA | |
| C. | 标准状况下,2.24 L H2O所含的原子总数为0.3 NA | |
| D. | 常温常压下,17g NH3含有的电子个数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
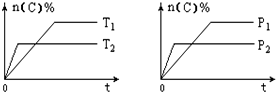 可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )| A. | 使用催化剂,C的物质的量分数增加 | |
| B. | 升高温度,平衡向正反应方向移动 | |
| C. | 化学方程式的系数a<c+d | |
| D. | 根据图象无法确定改变温度后平衡移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
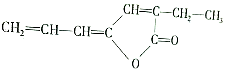 ,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:
,该物质在现代工业合成中大有用途,请回答下列有关该物质的问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
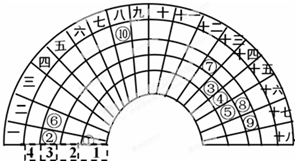 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | ⑥、⑧、⑨对应原子的半径依次减小 | |
| B. | ②、⑦的最高价氧化物对应的水化物能相互反应 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤形成的气态化合物稳定性大小为:⑤>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{16n}{3m-2n}$ | B. | $\frac{32n}{n-m}$ | C. | $\frac{32m}{3n-2m}$ | D. | $\frac{32n}{3n-2m}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com