
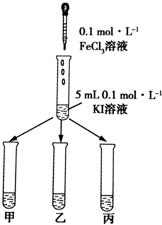
 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.| 序号 | 反应温度/℃ | C(HCl)/mol•L-1 | V(HCl)/ml | 10g碳酸钙的形状 | t/min |
| ① | 20 | 2 | 10 | 块状 | t 1 |
| ② | 20 | 4 | 10 | 块状 | t 2 |
| ③ | 20 | 2 | 10 | 粉末 | t 3 |
| ④ | 40 | 2 | 10 | 粉末 | t 4 |
| ⑤ | 40 | 4 | 10 | 粉末 | t5 |
分析 (1)若证明反应2Fe3++2I-=2Fe2++I2为可逆反应需要证明溶液中同时存在铁离子和碘单质;
(2)图表数据分析可知实验目的是探究影响化学反应速率的因素,主要是温度、浓度、接触面积对化学反应速率的影响;
(3)实验①和实验②是盐酸浓度不同其他条件相同,浓度对反应速率的影响,除浓度外,温度、接触面积也会影响化学反应速率;
(4)①②③④⑤组实验中温度升高对反应速率影响大,从④⑤中选择反应速率最大的一组;
解答 解:(1)若证明反应2Fe3++2I-=2Fe2++I2为可逆反应需要证明溶液中同时存在铁离子和碘单质,在KI溶液中滴加3mlFeCl3溶液,将混合液均匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉溶液,往试管乙中滴加KSCN溶液,若试管甲中出现蓝色证明碘单质存在,乙试管中出现血红色溶液证明含铁离子,说明反应是可逆反应,
故答案为:蓝色;血红色;
(2)图表数据分析可知,①②③④⑤组实验目的是探究影响化学反应速率的因素,主要是温度、浓度、接触面积对化学反应速率的影响,改变一个条件,对化学反应速率影响,由表格中的信息可知实验二的目的是探究影响化学反应速率的因素,
故答案为:影响化学反应速率的因素;
(3)实验①和实验②是盐酸浓度不同其他条件相同,探究浓度对反应速率的影响,除浓度外,图表中温度、接触面积也会影响化学反应速率,
故答案为:浓度; 温度、接触面积;
(4)五组实验分析可知对化学反应速率影响大的是温度升高,温度越高反应速率越快,反应需要的时间越短,从④⑤组选择,第⑤组实验中盐酸浓度大,反应速率快所需时间短,
故答案为:⑤;
点评 本题考查了影响化学反应反应速率的因素分析判断,主要是温度、浓度、接触面积对反应速率影响数据的分析应用,掌握分析方法是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某实验小组对一含有Al3+的未知溶液进行了如下分析:
某实验小组对一含有Al3+的未知溶液进行了如下分析:| A. | 该未知溶液中一定含有Al3+ Mg2+ H+三种阳离子 | |
| B. | 滴加的NaOH溶液的物质的量浓度为5 mol•L-1 | |
| C. | 若将最终沉淀过滤、洗涤、灼烧,其质量可能为6 g | |
| D. | 若另一种离子为二价阳离子,则a=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
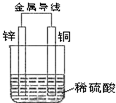 根据如图铜锌原电池示意图,回答下列问题:
根据如图铜锌原电池示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④ | B. | ②③ | C. | ①④ | D. | ① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com