
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2的体积(mL) | 672 | 840 | 896 | 672 |
分析 (1)对比Ⅰ、Ⅱ、Ⅲ可知,随着样品质量增加,生成二氧化碳的体积逐渐增大,说明Ⅰ、Ⅱ中盐酸过量,Na2CO3和NaHCO3的完全反应,设出Ⅰ中碳酸钠、碳酸氢钠的物质的量,然后根据总质量、生成二氧化碳的量列式计算;
(2)根据实验Ⅲ、Ⅳ可知,Ⅳ中盐酸不足,碳酸钠优先反应生成碳酸氢钠,然后碳酸氢钠与盐酸反应生成二氧化碳,根据(1)的计算结果计算出碳酸钠的物质的量,再根据反应HCl+Na2CO3=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑计算出HCl的物质的量,最后根据c=$\frac{n}{V}$计算出该盐酸的浓度.
解答 解:(1)结合Ⅰ、Ⅱ、Ⅲ可知,随着样品质量增加,生成二氧化碳的体积逐渐增大,说明Ⅰ、Ⅱ中盐酸过量,Na2CO3和NaHCO3的完全反应,
设出Ⅰ中Na2CO3、NaHCO3的物质的量分别为x、y,
则①106x+84y=2.96、②x+y=$\frac{0.672L}{22.4L/mol}$=0.03mol,联立①②解得:x=0.02mol、y=0.01mol,
所以样品中物质的量之比n(Na2CO3):n(NaHCO3)=0.02mol:0.01mol=2:1,
故答案为:2:1;
(2)根据实验Ⅲ、Ⅳ可知,Ⅳ中盐酸不足,Na2CO3优先反应生成NaHCO3,设6.66g样品中含有碳酸钠、碳酸氢钠的物质的量分别为2x、x,则106×2x+84x=6.66,解得:x=0.0225mol,即6.66g样品中含有0.045mol碳酸钠、0.0225mol碳酸氢钠,
将样品加入盐酸中,先发生反应HCl+Na2CO3=NaHCO3+NaCl,0.045mol碳酸钠完全反应消耗HCl的物质的量为0.045mol,碳酸钠完全反应后发生再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,生成标准状况下672L二氧化碳消耗HCl的物质的量为:n(HCl)=n(CO2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,
所以30mL盐酸中含有HCl的物质的量为:0.045mol+0.03mol=0.075mol,该盐酸的物质的量浓度为:c(HCl)=$\frac{0.075mol}{0.03L}$=2.5mol/L,
故答案为:2.5mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,正确判断反应物过量情况为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
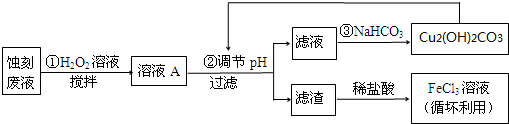
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
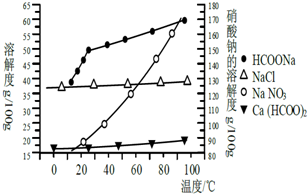 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.| 金属 离子 | 开始沉淀 的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
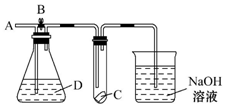 如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )
如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )| A. | 浓硫酸 | B. | NaOH溶液 | C. | 浓盐酸 | D. | 饱和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ③⑥ | C. | ①② | D. | ⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离对硝基甲苯和邻硝基甲苯:蒸馏 | |
| B. | 除去甲基丙烯酸甲酯中少量甲醇:蒸馏 | |
| C. | 除去漠苯中少量水:分液 | |
| D. | 从粗产品中提纯苯甲酸钠:重结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2在反应中只作氧化剂 | |
| B. | 由于Na2O2与H2O反应放出热量和氧气,所以脱脂棉剧烈燃烧 | |
| C. | Na2O2与H2O反应中有氢氧化钠生成,Na2O2是典型的碱性氧化性 | |
| D. | Na2O2与H2O反应中有氧气生成,可用于防毒面具上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
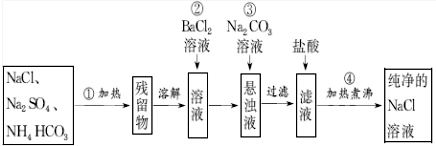
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com