


分析 B连续发生氧化反应生成D,二者反应得到乙酸乙酯,则B为CH3CH2OH,D为CH3COOH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步发生氧化反应生成乙酸,A是气态烃,与水反应生成乙醇,则A为CH2=CH2,以此解答(1)-(3);
(4)由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法分离,则A为乙酸乙酯,B为水层含有乙醇、乙酸钠,利用蒸馏方法分离出乙醇,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,故E为乙醇,C为乙酸钠,D为乙酸.
解答 解:(1)乙烯在一定条件下与水发生加成反应生成乙醇,方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH;
(2)B为CH3CH2OH,与钠反应的方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,由方程式可知制得1molH2需要2mol乙醇,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;2;
(3)乙醇发生氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)①乙酸乙酯不溶于饱和碳酸钠溶液,乙酸溶于水,可与碳酸钠反应,乙醇溶于水,可用饱和碳酸钠溶液分离,生成的乙酸钠可加入盐酸或硫酸,重新生成乙酸,
故答案为:饱和碳酸钠溶液;(b)稀HCl/稀H2SO4;
②乙酸乙酯是不溶于饱和碳酸钠溶液的物质,乙醇和乙酸均是易溶的,所以步骤①是互不相溶液体的分离,采用分液的方法,乙酸和乙醇的碳酸钠水溶液是互溶的,其中乙醇的沸点很低,可以采用蒸馏的方法将乙醇分离出来,
故答案为:分液;蒸馏.
点评 本题考查有机物的推断,为高频考点,侧重学生的分析能力的考查,涉及烯烃、醇、醛、羧酸的性质与转化,实验基本操作,题目难度中等,侧重对基础知识的巩固.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题

| A. | 试剂M 是HBr,加入HBr的目的是除去过量的Ca(OH)2 | |
| B. | 操作I为过滤,滤渣为Fe、Fe(OH)2和Fe(OH)3;操作Ⅱ为重结晶,具体操作步骤为蒸发浓缩、冷却结品、洗涤、干燥 | |
| C. | 制得的CaBr2•2H2O 可以通过以下方法测定纯度:称取一定量的样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,计算便得出CaBr2•2H2O的纯度 | |
| D. | 工业上也可以将氨气通入石灰乳,并加入溴,于65℃进行反应,制得溴化钙,此反应中还会生成一种无色气体,该反应的化学方程式为3Ca(OH)2+3Br2+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3CaBr2+N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(g)+HCl(g) 能自发进行,该反应的△H>0 | |
| B. | 多电子原子中,1s、2s、3s电子的能量逐渐增大,2p、3p、4p能级的轨道数依次增多 | |
| C. | 由 +H2$\stackrel{催化剂}{→}$ +H2$\stackrel{催化剂}{→}$ △H=+23kJ•mol-1可知, △H=+23kJ•mol-1可知, 比 比 更稳定 更稳定 | |
| D. | 丙酸甲酯的水解反应,加入稀硫酸会使平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
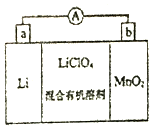 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是气体 | B. | B是气体 | ||
| C. | 如果C是气体,A、B一定是气体 | D. | 如果C是气体,B不一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
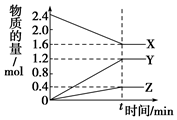 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )| A. | 该反应的化学方程式为:2X?3Y+Z | |
| B. | 10s内Y的平均速率为0.12 mol•L-1•min-1 | |
| C. | X的转化率为66.7% | |
| D. | 增大压强,该反应速率一定加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com