
| A. | 充电时阳极反应为Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时OH-向阳极移动 | |
| C. | 放电时每转移3mole-正极有1molK2FeO4被氧化 | |
| D. | 充电时,电源的正极应与电池的Zn(OH)2极相连 |
分析 充电时,阴极上电极反应式为Zn(OH)2+2e-=Zn+2OH-,阳极上电极反应式为2Fe(OH)3-6e-+10OH-=2FeO42-+8H2O,放电时,负极上电极反应式为Zn-2e-+2OH-=Zn(OH)2,正极上电极反应式为2FeO42-+8H2O+6e-=2Fe(OH)3+10OH-,再结合离子移动方向、转移电子和高铁酸钾之间的关系式解答.
解答 解:A.充电时,阳极上氢氧化铁失电子发生氧化反应,电极反应式为2Fe(OH)3-6e-+10OH-=2FeO42-+8H2O,故A错误;
B.充电时,该装置是电解池,电解质溶液中氢氧根离子向阳极移动,故B正确;
C.放电时,每转移3mol e-正极有1 mol K2Fe04被还原,故C错误;
D.充电时,氢氧化锌得电子发生还原反应,则应该作阴极,应该与原电池负极相连,故D错误;
故选B.
点评 本题考查了原电池和电解池原理,根据元素化合价变化确定电极反应,根据物质间的反应、离子的移动方向来分析解答,难点是电极反应式的书写,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
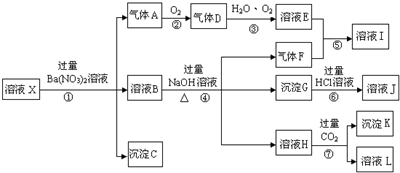
 ,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
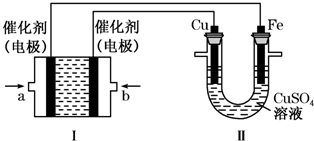 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阴极的电极反应式为 2Cl--2e-═Cl2↑ | |
| B. | 放电时,铅蓄电池中硫酸浓度不断减小 | |
| C. | 氢氧燃料电池中,当电路上有1mol 电子通过时,则正极上消耗氧气为5.6L | |
| D. | 以锌片、铜片、稀硫酸组成原电池,当溶液中通过0.2mol电子时,负极减轻6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
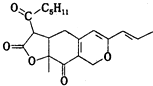
| A. | 红曲素含有两种含氧官能团 | |
| B. | 红曲素分子式为C21H25O5 | |
| C. | 红曲素能使酸性高锰酸钾溶液褪色 | |
| D. | lmol红曲素最多能与2 mol NaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com