
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 |
分析 A.如果酸为强酸,则10V甲=V乙,如果酸为弱酸,则10V甲<V乙;
B.两溶液都是酸溶液,酸溶液中的氢氧根离子是水电离的,根据水的离子积计算出水电离的氢氧根离子浓度;
C.如果生成的盐不水解,则两溶液的pH相等,如果生成的盐水解,则甲烧杯中溶液的碱性大于乙烧杯溶液的碱性;
D.如果酸是强酸,则恰好反应,溶液为中性;如果酸是弱酸,则酸过量,反应后的混合液可能显示酸性.
解答 解:A.若酸为强酸,则依据溶液吸稀释过程中氢离子浓度不变5ml×10-3=V×10-4,解得V=5Oml,则10V甲=V乙,若酸为弱酸,加水稀释时,促进弱酸的电离,电离产生的氢离子增多,要使pH仍然为4,加入的水应该多一些,所以10V甲<V乙,所以10V甲≤V乙,故A正确;
B.酸溶液中的氢氧根离子是水电离的,则pH=3的酸中,水电离的氢氧根离子浓度为,c(OH-)甲=$\frac{{K}_{W}}{c({H}^{+})}$=10-11mol/L,pH=4的酸中,水电离的氢氧根离子浓度为,c(OH-)乙=$\frac{{K}_{W}}{c({H}^{+})}$=10-10mol/L,则10c(OH-)甲=c(OH-)乙,故B正确;
C.稀释前后甲乙两个烧杯中所含的一元酸的物质的量相等,依据酸碱中和反应可知,消耗氢氧化钠的物质的量相等,生成的酸盐的浓度甲>乙,若酸为强酸,则二者的pH相等,若酸为弱酸,则甲溶液的pH大于乙,即:甲≥乙,故C错误;
D.若酸是强酸,分别与5mL pH=11的NaOH溶液反应,恰好发生酸碱中和,生成强酸强碱盐,溶液显中性,若为弱酸,则反应后酸有剩余,溶液可能显酸性,故D正确;
故选C.
点评 本题考查了弱电解质的电离、酸碱混合的定性判断及pH的相关计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,正确理解题意,明确弱酸存在电离平衡的特点为解答本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 加入少量NH4Cl固体,平衡逆移溶液中c(NH4+)减小 | |
| B. | 加入少量浓盐酸,浓盐酸与 NH3•H2O反应,电离平衡逆移 | |
| C. | 加热,电离平衡逆移 | |
| D. | 加水后,溶液中n(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
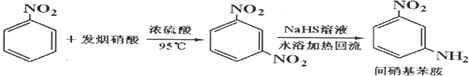
| 参考数据 | 组分 | 邻硝基苯胺 | 间硝基苯胺 | 对硝基苯胺 | 水 | 甲醇 | 硝基苯 |
| 沸点/℃ | 284 | 305.7 | 331.7 | 100 | 64.7 | 4.75 | |
| 偶极矩/D | 4.38 | 4.91 | 6.33 | 1.85 | 1.69 | 4.75 | |
| 颜色 | 橙色 | 淡黄色 | 淡黄色 | 无色 | 无色 | 淡黄色 |

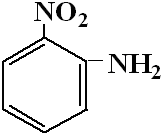 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应开始时容器体积为2 L,则v(C)=0.4mol•L-1•min-1 | |
| B. | 若该反应在恒温恒容下进行,放出热量将增加 | |
| C. | 若2 min后,向容器中再投入等物质的量A、C,则B的转化率不变 | |
| D. | 若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
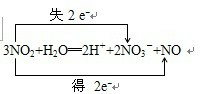 .
.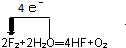 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与稀硫酸反应 | B. | Ba(OH)2溶液与Na2SO4溶液反应 | ||
| C. | Ba(OH)2溶液与NaHSO4溶液反应 | D. | Ba(NO3)2溶液与MgSO4溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率相等且都为零 | B. | 化学反应停止 | ||
| C. | 反应物和生成物共存 | D. | 反应物和生成物浓度均不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com