
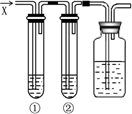
 如图所示,若向盛有溶液①和溶液②的试管中,通入过量气体X,最终①、②均有沉淀生成的是
如图所示,若向盛有溶液①和溶液②的试管中,通入过量气体X,最终①、②均有沉淀生成的是| 选项 | X | ①溶液 | ②溶液 |
| A | Cl2 | Na2SO3 | Na2S |
| B | SO2 | Na2SiO3 | Ba(NO3)2 |
| C | NH3 | AgNO3 | AlCl3 |
| D | HCl | CuSO4 | NaAlO2 |
| A、A | B、B | C、C | D、D |


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
 (1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子
(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 有些化学反应的化学能能直接转化成电能
有些化学反应的化学能能直接转化成电能
| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | II | 良 |

查看答案和解析>>
科目:高中化学 来源: 题型:
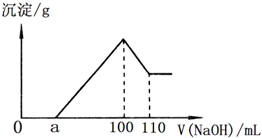 准确称取22.7g某矿石样品(含Al2O3、Fe2O3和不溶于水和酸的杂质),放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图所示.请回答:
准确称取22.7g某矿石样品(含Al2O3、Fe2O3和不溶于水和酸的杂质),放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图所示.请回答:查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省佛山市高三教学质量检测(二)理综化学试卷(解析版) 题型:实验题
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。

(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,装置C中NaOH溶液的作用是 。
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
;乙同学的推测是:2Mg+3SO2 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选。
|
序号 |
实验步骤 |
预期现象和结论 |
|
① |
取少量反应后所得固体于试管中 |
|
|
② |
向试管中的固体慢慢滴加 , 试管口塞上带导管的单孔塞,并将导管通入盛有 的试管中。 |
若试管中的 , 则丙同学推测正确。 若试管中的固体未完全溶解,且 ,则乙同学推测正确。 |
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是 。
(4)上述实验需要100mL,2mol/L的HCl,配制时选用 (选填10 mL、25 mL、50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为 mL。(保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com