
(15分)实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示(加热及夹持装置省略):

制备1,2--溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:
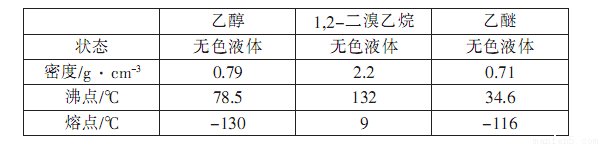
回答下列问题:
(1)装置A、D中发生主要反应的化学方程式为: ; 。
(2)装置B中长玻璃管E的作用: 。
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(4)在装置C中应加入____,其目的是完全吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸
c.氢氧化钠溶液 d.酸性KMnO4溶液
(5)反应过程中应用冷水冷却装置D.其主要目的是: ;但又不能过度:冷却(如用冰水),其原因是: ;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”)。
(1)C2H5OH CH2=CH2↑+H2O;CH2=CH2+Br2
CH2=CH2↑+H2O;CH2=CH2+Br2 CH2BrCH2Br
CH2BrCH2Br
(2)判断装置是否堵塞 (3)d (4)c (5)溴易挥发,冷水可减少挥发;如果用冷水冷却会使产品凝固而堵塞导管;下
【解析】
试题分析:(1)要制备1,2—二溴乙烷,则需要乙烯与溴水通过加成反应得到,因此A装置是制备乙烯的,则装置A、D中发生主要反应的化学方程式分别为C2H5OH CH2=CH2↑+H2O、CH2=CH2+Br2
CH2=CH2↑+H2O、CH2=CH2+Br2 CH2BrCH2Br。
CH2BrCH2Br。
(2)由于1,2—二溴乙烷的熔点较低,只有9℃.一旦在导管中冷凝变为固体,会堵塞导管。则此时B中的长导管中的液面会上升,所以装置B中长玻璃管E的作用是判断装置是否堵塞。
(3)由于在140℃时乙醇容易发生分子间脱水生成乙醚,所以在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右的最主要目的是减少副产物乙醚生成,答案选d。
(4)由于浓硫酸具有氧化性,在反应中有可能被还原为SO2,而SO2能使溴水褪色,会干扰实验。又因为乙烯具有还原性,能被酸性高锰酸钾溶液氧化,所以除去乙烯中的SO2应该选择氢氧化钠溶液,答案选c。
(5)由于液溴易挥发,因此反应过程中应用冷水冷却装置D的主要目的是减少挥发液溴;又由于1,2—二溴乙烷的熔点较低,如果用冷水冷却会使产品凝固而堵塞导管,所以又不能过度冷却(如用冰水);1,2-二溴乙烷不溶于水,密度大于水,所以将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层。
考点:考查有机物制备实验方案设计与探究


科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:选择题
下列对图象描述正确的是

A.图①表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系
B.图②表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应过程中,SO2和O2反应速率大小关系
2SO3(g)反应过程中,SO2和O2反应速率大小关系
D.图④表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH-
C.向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH- CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C.加热0.1 mol·L-1FeCl3溶液, Fe3+的水解程度增大、溶液的pH减小
D.向0.1 mol·L-1CH3COOH溶液中加水,则c(H+)与c(CH3COOH)的比值减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在0.01 mol·L-1Ba(OH)2溶液中:Al3+、NH4+、NO3-、HCO3-
B.在加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO3-
C.在含有苯酚的溶液中:K+、NH4+、Br-、Fe3+
D.在0.01mol·L-1HCl溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:实验题
(15分)电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
实验原理:CaC2+2H2O=Ca(OH)2+C2H2↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①取样品1.2g;
②把1.2 g样品放入气密性良好的气体发生装置,如图所示;
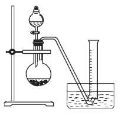
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平
④作为反应器的烧瓶中有24 mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、 、 、 。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,配平并完成化学方程式

若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市高三上学期期末理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向次氯酸钙溶液中通入少量CO2:2ClO-+H2O+CO2=CO32—+2HClO
B.向明矾溶液中加入足量Ba(OH)2溶液:Al3++2SO42—+4OH-+2Ba2+=2BaSO4↓+[Al(OH)4]-
C.向FeCl3溶液中加入足量单质锌:Zn+2Fe3+=Zn2++2Fe2+
D.向NaHSO4中滴加Ba(OH)2溶液至中性:H++SO42—+OH-+Ba2+=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关,下列说法不正确的是
A.Al2O3熔点高,可用于制作耐高温仪器
B.明矾净水与胶体的性质有关
C.H7N9型禽流感病毒在高温条件下被杀死的过程是蛋白质变性
D.高纯度的硅单质用于制作光导纤维,光导纤维有导电性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com