已知20℃时氯化钠的溶解度为36克.在该温度下,将碳酸钠与氯化钠的混合物17.2克,放入19克水中使其完全溶解,然后加入36.5克质量分数为20%的盐酸溶液,恰好完全反应.求:
(1)生成二氧化碳的质量
(2)反应后所得溶液的溶质的质量分数.
解:(1)m(HCl)=36.5g×20%=7.3g,
n(HCl)=
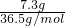
=0.2mol,
Na
2CO
3+2HCl=2NaCl+CO
2↑+H
2O
2 2 1
0.2mol n(NaCl) n(CO
2)
n(CO
2)=0.1mol,
V(CO
2)=0.1mol×44g/mol=4.4g,
答:生成二氧化碳的质量为4.4g.
(2)
Na
2CO
3+2HCl=2NaCl+CO
2↑+H
2O
1 2 2 1
n(Na
2CO
3) 0.2mol n(NaCl) n(H
2O)
n(Na
2CO
3)=0.1mol,
m(Na
2CO
3)=0.1mol×106g/mol=10.6g,
则原混合物中含有NaCl的质量为17.2g-10.6g=6.6g,
反应生成NaCl的n(NaCl)=0.2mol,
反应生成NaCl的质量为:0.2mol×58.5g/mol=11.7g,
所以:反应后所得溶液的溶质的质量为:6.6g+11.7g=18.3g,
36.5克质量分数为20%的盐酸溶液中水的质量为:36.5g×80g=29.2g,
生成水的质量为:0.1mol×18g/mol=1.8g,
水的总质量为:19g+29.2g+1.8g=50g,
则有:
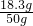
>
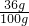
,溶液达到饱和,
所以:所得溶液的溶质的质量分数为:

=26.5%,
答:反应后所得溶液的溶质的质量分数26.5%.
分析:(1)根据反应:Na
2CO
3+2HCl=2NaCl+CO
2↑+H
2O,计算出盐酸的物质的量,结合方程式计算生成二氧化碳的质量;
(2)计算反应后溶液中总NaCl的质量,判断溶液是否达到饱和,进而计算反应后所得溶液的溶质的质量分数.
点评:本题考查混合物的计算,题目难度中等,注意判断反应后溶液是否达到饱和为解答该题的关键.

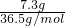 =0.2mol,
=0.2mol,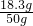 >
>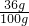 ,溶液达到饱和,
,溶液达到饱和, =26.5%,
=26.5%,
