
下列物质不具有各向异性的是( )
A.胆矾 B.水晶
C.玻璃 D.芒硝
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
参考表中物质的熔点,回答有关问题。
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点/℃ | -90.2 | -70.4 | 5.2 | 120.0 | -70.4 | -49.5 | -36.2 | -15.0 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的__________有关,随着__________的增大,熔点依次降低。
(2)硅的卤化物及硅、锗、锡、铅的氯化物的熔点与________________有关,随着________________增大,________________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与__________有关,因为一般__________比__________的熔点高。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质结构理论推出:金属晶体中金属阳离子与自由电子之间的强烈的相互作用,叫金属键。金属键越强,其金属的硬度越大,熔、沸点越高,且据研究表明,一般说来金属原子半径越小,价电子数越多,则金属键越强。由此判断下列说法错误的是( )
A.镁的硬度小于铝
B.镁的熔、沸点低于钙
C.镁的硬度大于钾
D.钙的熔、沸点高于钾
查看答案和解析>>
科目:高中化学 来源: 题型:
现有甲、乙、丙三种晶胞,如图所示。
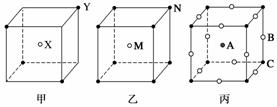
甲中X处于晶胞中心;乙中M处于晶胞中心;丙中A处于晶胞中心,B处于棱上,C处于顶点。由此可知:
(1)甲晶胞中X与Y的个数之比为________________________________________。
(2)乙晶胞中M与N的个数之比为________________________________________。
(3)丙的化学式是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
德国和美国科学家首次研制出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由多个正五边形构成的(如图所示)。请回答:
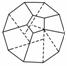
(1)C20分子中共有________个正五边形,共有 条棱边。C20晶体属于________(填晶体类型)。
(2)固体C60与C20相比较,熔点较高的应为________,理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
A.具有规则几何外形的固体一定是晶体
B.晶体与非晶体的根本区别在于是否具有规则的几何外形
C.具有各向异性的固体一定是晶体
D.晶体、非晶体都具有固定的熔点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com