
| A. | 已知P(红磷,s)=P(白磷,s)△H>0,则白磷比红磷稳定 | |
| B. | 测定相同物质的量浓度的Na2CO3、Na2SiO3的溶液pH,发现后者的更高,说明碳的非金属性强于硅 | |
| C. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态. | |
| D. | 将NaAlO2溶液与NaHCO3溶液混合后生成白色沉淀,是两种溶液水解相互促进的结果 |
分析 A、根据能量越低的物质就越稳定,白磷转化成红磷是放热反应,故红磷的能量低,红磷稳定;
B、测定相同物质的量浓度的Na2CO3、Na2SiO3的溶液pH,发现后者的更高,说明碳酸酸性比硅酸酸性强;
C、根据PM=ρRT,混合气体的密度不再改变,说明气体的平均相对分子质量不变;
D、化学反应遵循强酸制弱酸的规律.
解答 解:A、根据能量越低的物质就越稳定,白磷转化成红磷是放热反应,故红磷的能量低,红磷比白磷稳定,故A错误;
B、最高价氧化物对应水化物的酸性越强,中心元素的非金属性越强,测定相同物质的量浓度的Na2CO3、Na2SiO3的溶液pH,发现后者的更高,说明碳酸酸性比硅酸酸性强,所以碳的非金属性强于硅,故B正确;
C、根据PM=ρRT,混合气体的密度不再改变,说明气体的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态,故C正确;
D、学反应遵循强酸制弱酸的规律,NaHCO3溶液与NaAlO2溶液混合产生白色沉淀氢氧化铝,则证明酸性:HCO3->Al(OH)3,而不是双水解,故D错误;
故选BC.
点评 本题是一道物质性质实验方案的设计题,考查学生对物质性质的灵活掌握以及分析和解决问题的能力,难度大,综合性强.


科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: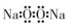 | B. | 次氯酸分子的结构式:H-Cl-O | ||
| C. | C60和石墨互为同位素 | D. | 具有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
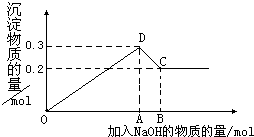 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 符合的条件 | 物质的化学式或名称 |
| (1) | 混合物 | |
| (2) | 电解质,但熔融状态下并不导电 | |
| (3) | 电解质,但难溶于水 | |
| (4) | 非电解质 | |
| (5) | 既不是电解质,也不是非电解质,但本身能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||||
| T | Q | W |
| A. | 工业电解熔融的 TW3制得单质T | |
| B. | 元素R和元素Q的最高正化合价相同 | |
| C. | 单核阴离子半径的大小顺序为r(Q)>r(W)>r(R) | |
| D. | 阴离子的还原性:Q<W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
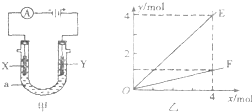 电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )
电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com