
| A. | 2-丙醇的结构式:CH3CHOHCH3 | |
| B. | 丙烯分子的结构简式为 CH3CH CH 2 | |
| C. | 四氯化碳分子的电子式为: | |
| D. | 2-乙基-1,3-丁二烯的键线式: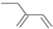 |
分析 A.结构简式是用短线“-”代替共用电子对,未成键的孤对电子对不需要标出;
B.烯烃中碳碳双键为官能团,书写结构简式不能省略;
C.氯原子未成键的孤对电子对未标出;
D.键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出;
解答 解:A.CH3CHOHCH3是2-丙醇的结构式,故A错误;
B.丙烯分子的结构简式为 CH3CH=CH 2,故B错误;
C.氯原子未成键的孤对电子对未标出,四氯化碳电子式为 ,故C错误;
,故C错误;
D.2-乙基-1,3-丁二烯的结构简式为: ,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为:
,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为: ,故D正确;
,故D正确;
故选:D.
点评 本题考查了化学用语,侧重考查有机物结构式、结构简式、电子式、键线式表示方法,解题时注意结构简式中碳碳双键、碳碳三键为官能团不能省略,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
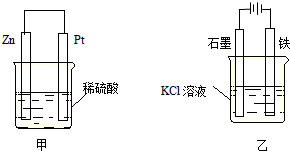
| A. | 该装置能形成原电池,其中锌是负极 | |
| B. | 该装置能形成原电池,其中铜是负极 | |
| C. | 该装置不能形成原电池 | |
| D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 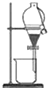 用于分离水和乙醇的混合物 | |
| B. | 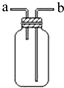 可用于H2,NH3,CO2,Cl2,HCl,NO2等气体收集 | |
| C. | 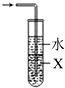 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| D. | 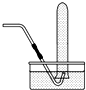 常用于实验室收集氧气、氢气等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变小 | |
| B. | 常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大 | |
| C. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 | |
| D. | 已知,K=$\frac{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}{{c}^{3}({H}_{2}O)•c(C{H}_{3}C{H}_{2}OH)}$则对应的化学反应可以表示为:CH3CH2OH(g)+3H2O(g)?2CO2( g)+6H2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4H中 H+的核外电子排布与He相同 | |
| B. | NH4H溶于水,所形成的溶液显碱性 | |
| C. | NH4H固体投入少量的水中,有两种气体产生 | |
| D. | NH4H与水反应时,NH4H是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
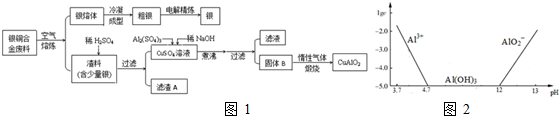
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com