
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 据有机物属于酯类,且分子结构中有苯环,则应含有-COO-官能团,则取代基分别为-CH3和-OOCH或-OOCCH3或-COOCH3或-CH2OOCH,有2个取代基时,有邻、间、对三不同结构,据此进行解答.
解答 解:苯乙酸(C6H5CH2COOH)的同分异构体中含有酯基和苯环,说明满足条件的有机物的苯环上含有取代基-CH3和-OOCH或-OOCCH3或-COOCH3或-CH2OOCH
①取代基为-CH3和-OOCH时,存在邻、间、对三种同分异构体;
②取代基为C6H5-OOCCH3或C6H5-COOCH3或C6H5-CH2OOCH时,各存在一种同分异构体,
所以总共含有6种同分异构体,
故选D.
点评 本题考查同分异构体的书写方法,题目难度不大,明确常见有机物的官能团和结构为解答该题的关键,注意掌握同分异构体的书写原则.


科目:高中化学 来源: 题型:解答题
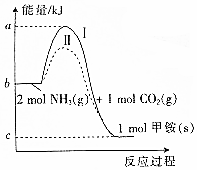 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | CF2=CF2 | C. | CCl2F2 | D. | SF6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Na着火,立即用水扑灭 | |
| B. | 做蒸馏实验时,应使温度计水银球位于蒸馏烧瓶支管口处 | |
| C. | 衣服沾上大量浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中 | |
| D. | 测试某溶液的pH时,先用水润湿pH试纸,再将待测液滴到pH试纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能和氢氧化钠溶液反应,而乙醇不能和氢氧化钠溶液反应 | |
| B. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯能发生加成反应,而乙烷不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-中氯元素显+1价,具有很强的还原性 | |
| B. | 这些离子结合H+的能力,ClO4-最强 | |
| C. | ClO3-是NO3-的等电子体,其空间构型为平面三角形 | |
| D. | ClO2-、ClO3-、ClO4-中的氯原子都采取sp3杂化,离子中相邻两个Cl-O键间键角依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOCH3 | B. | CH3COCH3 | C. | C6H5OH | D. | CH2=CH-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.
①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com