
【题目】氯化铁水解的离子方程式为______________,其溶液中离子浓度大小顺序为_____________。现向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其反应的离子方程式为:__________________。同时有红褐色沉淀生成,其原因是____________________。
【答案】Fe3++3H2O![]() Fe(OH)3 + 3H+ c(Cl﹣)>c(Fe3+)>c(H+)>c(OH﹣) CaCO3 + 2H+ = Ca2+ + H2O +CO2 ↑ 碳酸钙消耗H+,促进铁离子的水解,使 Fe(OH)3不断增加,形成红褐色沉淀。
Fe(OH)3 + 3H+ c(Cl﹣)>c(Fe3+)>c(H+)>c(OH﹣) CaCO3 + 2H+ = Ca2+ + H2O +CO2 ↑ 碳酸钙消耗H+,促进铁离子的水解,使 Fe(OH)3不断增加,形成红褐色沉淀。
【解析】
Fe3+水解生成Fe(OH)3,水解使溶液显弱酸性,可使碳酸钙逐渐溶解。
氯化铁为强酸弱碱盐,水解使溶液显弱酸性,水解的离子方程式为:Fe3++3H2O![]() Fe(OH)3 + 3H+,溶液中离子浓度的大小关系为:c(Cl﹣)>c(Fe3+)>c(H+)>c(OH﹣);向氯化铁溶液中加入碳酸钙粉末,由于Fe3+水解生成了H+,H+与CaCO3反应产生了无色气体,离子方程式为:CaCO3 + 2H+ = Ca2+ + H2O +CO2 ↑;碳酸钙消耗H+,促进了铁离子的水解,使 Fe(OH)3不断增加,因此有红褐色沉淀生成。
Fe(OH)3 + 3H+,溶液中离子浓度的大小关系为:c(Cl﹣)>c(Fe3+)>c(H+)>c(OH﹣);向氯化铁溶液中加入碳酸钙粉末,由于Fe3+水解生成了H+,H+与CaCO3反应产生了无色气体,离子方程式为:CaCO3 + 2H+ = Ca2+ + H2O +CO2 ↑;碳酸钙消耗H+,促进了铁离子的水解,使 Fe(OH)3不断增加,因此有红褐色沉淀生成。


科目:高中化学 来源: 题型:
【题目】下列溶液中的离子关系正确的是( )
A.相同温度下,0.2 mol·L-1的醋酸溶液与0.l mol·L-1的醋酸溶液中c(H+)之比大于2 : 1
B.pH=3的醋酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等
C.0.l mol﹒L-1NaHSO4溶液中:c(H+)=c(SO![]() ) +c(OH-)
) +c(OH-)
D.pH=4、浓度均为0.l mol·L-1的CH3COOH、CH3COONa 混合溶液中:c(CH3COO-)-c(CH3COOH)=10-4-10-10mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(举一反三)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
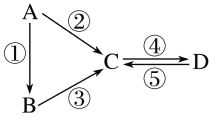
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:_____________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:_____________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:___________________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:_______________________________。
D的化学式是________。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应X(g)+3Y(g)![]() 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
①Z生成的速率与Z分解的速率相等 ②单位时间生成a mol X,同时生成3a mol Y
③X、Y、Z的浓度不再变化 ④X、Y、Z的分子数比为1:3:2
⑤X、Y、Z的浓度相等 ⑥X、Y、Z的质量不再发生变化
A.①③⑥B.①②③C.①②⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液里lgX[X表示![]() 或
或![]() ]随pH的变化关系如图所示。下列说法不正确的是
]随pH的变化关系如图所示。下列说法不正确的是
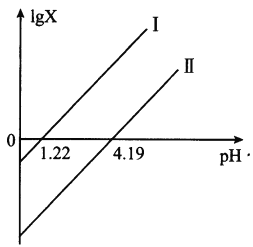
A. 直线I中X表示的是![]()
B. 直线I、Ⅱ的斜率均为1
C. c(HC2O4-)>c(C2O42-)>c(H2C2O4)对应1.22<pH<4.19
D. c(Na+)=c(HC2O4-)+2c(C2O42-)对应pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
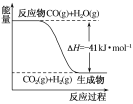
①反应的热化学方程式为:_______________________________________。
②已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131 kJ·mol-1,则C(s)+CO2(g)=2CO(g)ΔH=________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g)ΔH=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨可用于制取氨水、氮肥、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业.
(1)以甲烷为原料可制得合成氨用的氢气,有关反应的能量变化如下图所示:
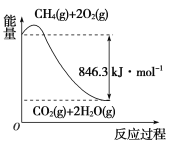
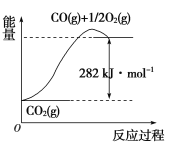
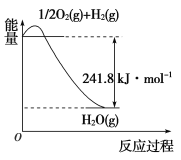
写出CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式:_______________。
(2)已知N2(g)+3H2(g)![]() 2NH3(g);△H= -94.4kJ·mol-1,在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:
2NH3(g);△H= -94.4kJ·mol-1,在某容积为2L的恒容容器中发生合成氨反应,体系中各物质浓度随时间变化的曲线如图所示:
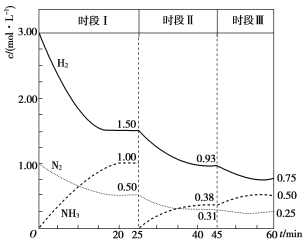
①前20min内v(NH3)=________mol/(L·min),放出的热量为________。
②45min时采取的措施是________;时段III条件下反应的平衡常数为________(保留3位有效数字)。
(3)一定温度下,将不同量的CO2、NH3分别通入某恒容密闭容器中进行下列反应:2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(g);△H<0,得到如下数据:
实验组 | 起始量/mol | 平衡时的转化率 | 平衡时气体平均相对分子质量 | ||
NH3(g) | CO2(g) | NH3(g) | CO2(g) | ||
1 | 2 | 1 | a1 | a2 | M1 |
2 | 4 | 2 | a3 | a4 | M2 |
3 | n1 | n2 | a5 | a6 | M3 |
①a1________a4(填“<”、“=”或“>”);M1________ M2(填“<”、“=”或“>”)。
②若a5>a6,则n1,n2必须满足的关系是________。
(4)室温时将氨通入500mL 0.1mol·L-1盐酸中至pH=6,所得溶液中离子浓度由大到小的顺序是____________________________________________。
(5)氨、空气、KOH溶液可构成燃料电池,反应原理为4NH3+3O2=2N2+6H2O,反应一段时间后,电解质溶液的pH将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示与对应叙述相符的是
A.图 表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则 Ksp(FeS)<Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则 Ksp(FeS)<Ksp(CuS)
B.图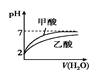 表示等体积的pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
表示等体积的pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C.某温度下向20 mL 0.1 mol·L-1的CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,pH变化曲线如图所示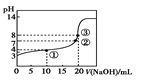 (忽略温度变化),则①点(CH3COO—)>c(Na+)>c(CH3COOH)
(忽略温度变化),则①点(CH3COO—)>c(Na+)>c(CH3COOH)
D.图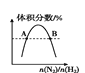 表示反应N2(g)+3H2(g)
表示反应N2(g)+3H2(g)![]() 2NH3(g)平衡时NH3体积分数随起始 n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始 n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解CuSO4 和KNO3的混合溶液500mL,经过一段时间后,两极均得到标准状况下11.2L的气体,则原混合液中CuSO4的物质的量浓度为( )
A.0.5 molL﹣1B.0.8 molL﹣1C.1.0 molL﹣1D.1.5 molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com