
【题目】实验室进行下列实验时,温度计水银球置于反应物液面以下的是 ( )
A.乙醇和浓硫酸混合加热到170°C制乙烯B.从石油中提炼汽油
C.用蒸馏方法提纯水D.实验室制取硝基苯
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
(1)表示甲醇完全燃烧热的的热化学方程式为________________;
(2)反应②中的能量变化如图所示,则ΔH2=__________。(用E1、E2的相关式子表示);

(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) △H2
NH4HCO3(aq) △H2
反应Ⅲ: (NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) △H3
2NH4HCO3(aq) △H3
则ΔH3与ΔH1 、ΔH2与之间的关系为ΔH3 =_________;
(4)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量:
化学键 | H﹣H | N﹣H | N≡N |
键能/kJ/mol | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值______。(注明“+”或“﹣”)。
2NH3(g) ΔH=akJ/mol,试根据表中所列键能数据估算a的值______。(注明“+”或“﹣”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理。按照实验步骤依次回答下列问题:

(1)铜为___极,导线中电子流向为___(用a、b表示)。
(2)若装置中铜电极的质量增加3.2g,则导线中转移的电子数目为___;(用若NA表示阿伏加德罗常数,“NA”表示)
(3)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是___。
A.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
B.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
C.盐桥中的K+、Cl-几乎都不移动
(4)若将反应2Fe3+ +Cu=2Fe2+ +Cu2+设计成原电池,其正极反应是___。
(5)设计一个电化学装置,实现这个反应:Cu+H2SO4=CuSO4+H2↑,请在下面方框内画出这个电化学装置图。___

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B. 已知C(s)+O2(g)=CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则2ΔH1<ΔH2
C. 已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
D. 已知:C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___,基态D原子价电子的轨道表达式为___,DA2分子的VSEPR模型是___。
(2)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图1所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
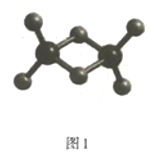
①C2Cl6属于___晶体(填晶体类型),其中C原子的杂化轨道类型为___杂化。
②[C(OH)4]-中存在的化学键有___。
③C2Cl6与过量的NaOH溶液反应的化学方程式为___。
(3)B、C的氟化物晶格能分别是2957kJmol-1、5492kJmol-1,二者相差很大的原因是___。
(4)D与E所形成化合物晶体的晶胞如图2所示。
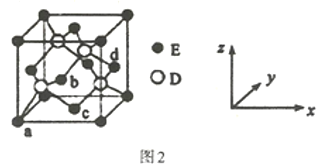
①在该晶胞中,E的配位数为___。
②已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为___pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填序号)。

(1)芳香烃:_____________ ;
(2)卤代烃:_____________;
(3)醇:_______________ ;
(4)酚:_____________;
(5)醛:_______________ ;
(6)酮:_____________;
(7)羧酸:_____________ ;
(8)酯:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d四种短周期元素在周期表中的位置如图所示,a和b分别位于周期表的第2列和第13列,下列叙述正确的( )

A.离子半径b>d
B.b可以和强碱溶液发生反应
C.c的最简单氢化物的空间结构为三角锥形
D.a的最高价氧化物对应水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、S、Cu 均为前四周期常见元素。回答下列问题。
(1)S 位于元素周期表第_____族;N 的基态原子核外有_____个未成对电子。
(2)N、O、S 三种元素的第一电离能从大到小的顺序为_________;CuH 晶体中金属阳离子的基态核外电子排布式为_____。
(3)比较沸点:H2O_____H2S(填“>”、“<”或“=”);干冰熔化时克服微粒间的 作用力类型是_________。
(4)SO42-的立体构型为_____;NO2- 中氮原子的杂化轨道类型为________, 与其是等电子体的分子有_________(填 1 个)。
(5)Cu2O 晶体如图所示的晶胞中每个氧原子与_____个铜原子配位。Cu2O 晶体 的密度为 dg·cm-3,则 Cu 与 O 的最近距离是_________(用 M 表示 Cu2O 的摩尔质量,NA 表示阿伏加德罗常数值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________。
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是___________________________。
(3)NH3分子的立体构型为_________,中心原子的杂化类型是_________。
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________,电负性最小的是_________。(填元素符号)
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________。
(6)氮与铜形成的一种化合物的晶胞结构如图所示。
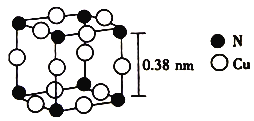
与每个Cu原子紧邻的Cu原子有_________个,阿伏加德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com