
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:

(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O![]() 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O![]() 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。

(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO![]() ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO![]() +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
【答案】 +6 ![]()
![]()
![]() 0.64
0.64 ![]() 6
6 ![]() 或
或![]()
![]() 双氧水在较高温度下发生分解,浓度降低
双氧水在较高温度下发生分解,浓度降低
【解析】(1)钠元素的化合价为![]() 价,氧元素的化合价为
价,氧元素的化合价为![]() 价,根据化合价代数和为0,可得铁元素的化合价为
价,根据化合价代数和为0,可得铁元素的化合价为![]() 价;次氯酸钠属于离子化合物,由钠离子和次氯酸根离子组成,其电子式为
价;次氯酸钠属于离子化合物,由钠离子和次氯酸根离子组成,其电子式为![]() ;正确答案:+6 ;
;正确答案:+6 ;![]() 。
。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是 ;正确答案:
;正确答案: 。
。
(3)硫酸亚铁被双氧水氧化为硫酸铁,反应的离子方程式是:![]() ;正确答案:
;正确答案:![]() 。
。
(4)根据电子得失守恒规律可知:1molNa2FeO4中铁元素由+6价降低到+3价,得到3mol电子;1mol氯气由0价降低到-1价,得到2 mol电子;所以:设两种消毒剂的质量为1g,所以1gNa2FeO4得电子的量为1/166×3=0.018mol; 1g氯气得电子的量为1/71×2=0.028mol,所以Na2FeO4的消毒效率约是氯气的0.018/0.028=0.64 ;正确答案:0.64 。
(5)根据题给信息可知:SO2做还原剂,能够把Cr2O![]() 还原为Cr3+;离子方程式为:
还原为Cr3+;离子方程式为:![]() ;正确答案:
;正确答案:![]() 。
。
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,Cr(OH)3的酸式电离方程式:![]() 或
或![]() ;正确答案:
;正确答案:![]() 或
或![]() 。
。
(6)根据K
(8)根据图像可知:![]() ,双氧水在较高温度下发生分解,浓度降低;正确答案:
,双氧水在较高温度下发生分解,浓度降低;正确答案:![]() ,双氧水在较高温度下发生分解,浓度降低。
,双氧水在较高温度下发生分解,浓度降低。


科目:高中化学 来源: 题型:
【题目】25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是

A. 随着溶液pH增大,![]() 不断增大
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH约为8.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中Ca2+、Mg2+、SO![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A. ②④⑤①③ B. ④②⑤①③ C. ②⑤④①③ D. ⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI
+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是_________;氧化产物与还原产物的物质的量比是__________;如果反应生成0.3mol的单质碘,则转移的电子数目是_______。
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是___________________________;
(3)若采用下图实验装置将四氯化碳和I2的混合溶液分离。

写出图中仪器的名称:①_____;该装置还缺少的仪器是_____;冷凝管的进水口是:_____(填g或f)
(4)在容量瓶的使用方法中,下列操作正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(5)上面实验中用到一定物质的量浓度的稀硫酸,若配制0.5mol/L的硫酸溶液500mL,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______ mL,如果实验室有15mL、20mL、50mL量筒,应选用________ mL量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是_____________。
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,分别进行下列两项实验:
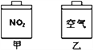
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
已知:N2O4(g)![]() 2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年5月,我国四川地区发生特大地震灾害,地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。氯气(Cl2)是制备消毒剂的主要原料之一。工业上主要采用电解饱和食盐水的方法来制取Cl2。请回答下列问题:
(1)电解之前,食盐水需要精制,目的是除去粗盐的中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①Na2CO3溶液 ②Ba(OH)2溶液 ③稀盐酸。其中合理的加入顺序为___(填序号);
(2)实验室欲配制6.00 mol/L的食盐水90 mL,回答下列问题:
①需要纯净的NaCl___________________g。
②可供选择的仪器有:a玻璃棒 b烧瓶 c烧杯 d胶头滴管 e试管 f托盘天平、砝码 h药匙。在配制食盐水时不需要使用的有_______(填字母),还缺少的仪器是__________。
③配制溶液时,一般可以分为以下几个步骤:计算称量溶解(________________________)转移(_____________________)定容(__________________________)装瓶。
④下列操作会使所配溶液的浓度偏小的是___________________。
A. 转移完溶液后未洗涤玻璃棒和烧杯 B. 容量瓶中原来有少量蒸馏水
C. 定容时,俯视刻度线 D. 称量氯化钠固体时左码右物
(3)在电解饱和食盐水过程中,还生成了H2和NaOH,则所发生反应的化学反应方程式为_____________________________;
(4)将电解生成的Cl2通入NaOH溶液,生成两种盐,其中一种是消毒液的主要成分NaClO,应用氧化还原反应原理,写出此反应的化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于可逆反应的是( )
A.Cl2与水反应
B.水电解生成H2 和H2在O2中燃烧生成水的相互转化过程
C.工业合成氨
D.氨气与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铷元素(Rb)位于元素周期表中第五周期第ⅠA族,有关Rb及其化合物的性质推测正确的是( )
A.Rb与冷水反应比K更剧烈
B.Rb投入CuSO4溶液中可置换出Cu
C.Rb与O2反应只有Rb2O产生
D.Rb2CO3难溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com