
| A. | 11:1 | B. | 9:1 | C. | 1:11 | D. | 1:9 |
分析 根据pH结合Kw计算溶液中氢离子和氢氧根离子浓度,根据混合溶液中c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{V(酸)+V(碱)}$计算.
解答 解:此温度下pH=12的氢氧化钠溶液中氢氧根离子浓度为0.1mol/L,pH=2的强酸溶液c(H+)=1.0×10-2mol/L,
假设碱的体积为aL,酸的体积为bL,
混合后溶液的pH=10,则c(OH-)=0.001mol/L,
混合溶液中c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{V(酸)+V(碱)}$=$\frac{0.1mol/L×aL-0.01mol/L×bL}{a+b}$=0.001mol/L,
a:b=1:9,
故选D.
点评 本题考查了pH的简单计算,侧重于学生的分析、计算能力的考查,注意把握基本的pH计算公式,把握离子浓度与离子键常数的关系,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有乙烷 | D. | 一定有甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2,NaOH,NaHCO3 | B. | Na2CO3,MgCl2,H2SO4 | ||
| C. | AgNO3,HCl,NaOH | D. | Ba(OH)2,CaCl2,Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.
在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH | |
| D. | 电解精炼铜时,杂质银变成银离子进入溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往溶液中加入浓溴水,出现白色沉淀,说明含有苯酚 | |
| B. | 向含酚酞的氢氧化钠溶液中加入溴乙烷,加热后红色变浅,说明溴乙烷发生了水解 | |
| C. | 在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明还有乙酸剩余 | |
| D. | 将乙醇和浓硫酸共热后得到的气体通入溴水中,溴水褪色,说明生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
实验 | 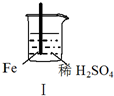 | 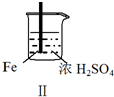 | 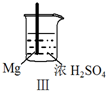 | 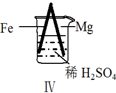 |
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
| A. | I中产生气体的原因是:Fe+2H+═Fe2++H2↑ | |
| B. | 取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体 | |
| C. | Ⅲ中现象说明Mg在浓H2SO4中没被钝化 | |
| D. | Ⅳ中现象说明Mg的金属性比Fe强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com