
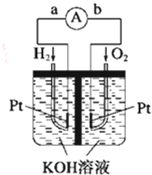
 燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
燃料电池是符合绿色化学理念的新型发电装置.如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:分析 (1)原电池是将化学能转变为电能的装置,原电池放电时,电子从负极沿导线流向正极;
(2)负极上燃料失电子发生还原反应,正极上氧气得电子生成氢氧根离子;
(3)根据化合价升高失电子发生氧化反应是还原剂,化合价降低得电子发生还原反应是氧化剂判断;
(4)甲烷-氧气燃料电池,负极甲烷失电子结合氢氧根生成碳酸根;
(5)肼(N2H4)-氧气燃料电池,负极N2H4失电子结合氢氧根生成氮气.
解答 解:(1)该装置是把化学物质中的能力转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,又氢氧燃料电池中氢气为负极,氧气为正极,所以导线中电子流动方向为由a到b,
故答案为:化学能转变为电能;a到b;
(2)碱性环境中,该反应中负极上氢气失电子生成氢离子,电极反应式为H2+2OH--2e-═2H2O,正极上氧气得电子生成氢氧根离子,电极反应式为2H2O+O2+4e-═4OH-,故答案为:2H2+4OH--4e-═4H2O;2H2O+O2+4e-═4OH-;
(3)2Li+H2$\frac{\underline{\;\;△\;\;}}{\;}$2LiH,该反应中锂失电子发生氧化反应,所以锂是还原剂,H元素化合价降低,被还原,H2为氧化剂;LiH+H2O=LiOH+H2↑反应中H2O得电子生成氢气,发生还原反应,所以H2O是氧化剂,LiH中H元素升高,被氧化,LiH为还原剂,故答案为:Li;H2O;
(4)甲烷-氧气燃料电池,负极甲烷失电子结合氢氧根生成碳酸根,则反应式为:CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(5)肼(N2H4)-氧气燃料电池,负极N2H4失电子结合氢氧根生成氮气,则反应式为:N2H4-4e-+4OH-=N2↑+4H2O,故答案为:N2H4-4e-+4OH-=N2↑+4H2O.
点评 本题考查化学电源的工作原理,题目难度不大,注意原电池电极反应式的书写.


科目:高中化学 来源: 题型:实验题
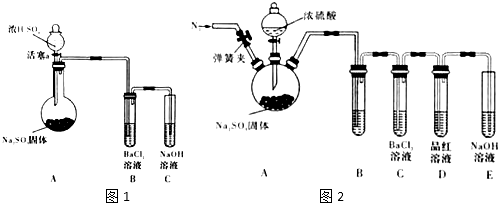
 溴乙烷是有机合成中的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成中的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
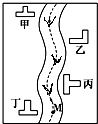 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示).它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示).它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.| 实验过程 | 冷水 | 热水 |
| 开始 | 红色扩散较慢 | 红色扩散较快 |
| 长久放置 | 最终均成为红色、均匀、透明的液体 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
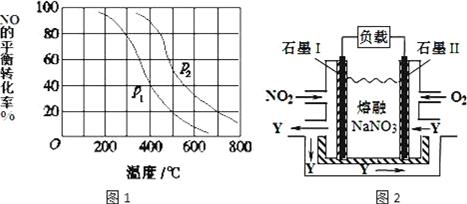
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
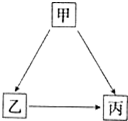 甲、乙、丙三种物质有如图所示的转化关系.
甲、乙、丙三种物质有如图所示的转化关系.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
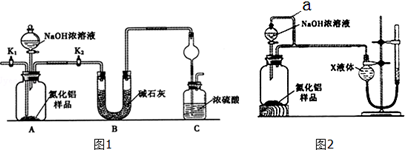

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com