
下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100ml 2mol/L的盐酸跟锌片反应时,加入适量的氯化钠溶液,反应速率减慢
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO反应转化为无害的N2和CO2,减小压强,反应速率减慢
科目:高中化学 来源:2017届宁夏高三上学期统练二化学试卷(解析版) 题型:选择题
—定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g) CH3OH(g)达到平衡。下列说法错误的是( )
CH3OH(g)达到平衡。下列说法错误的是( )

A.该反应的正反应放热
B.达到平衡时,容器I中反应物转化率比容器II中的小
C.达到平衡时,容器II中c(H2)大于容器III中的两倍
D.达到平衡时,容器III中的正反应速率比容器I中的大
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应中属于阴影3区域的是

A.Cl2+2NaI=2NaCl+I2
B.NH4HCO3 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol﹒L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
某固定体积的密闭容器中,加入—定量的A达化学平衡: aA(g) B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
A.若a=b+c时,B的物质的量分数变大 B.若a=b+c时,B的物质的量分数不变
C.若a>b+c时,A的转化率不变 D.若a<b+c时,A的转化率变大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为____________,属于___________分子(填“极性”或“非极性”),E的基态原子的外围电子排布式为____________。
(2)B、C、D三种元素 的第一电离能由小到大的顺序为____________。
的第一电离能由小到大的顺序为____________。
(3)C元素形成含氧酸酸性强弱:HNO3____________H NO2(填“>”或“<”)NO3—的空间构型是___________,NO2—中心原子的杂化方式为___________
NO2(填“>”或“<”)NO3—的空间构型是___________,NO2—中心原子的杂化方式为___________
(4)下列叙述正确的是____________(填序号)。
A. M是极性分子,N是非极性分子
B. M和BD2分子中的中心原子均采用sp2杂化
C. N分子中含有6个σ键和1个大π键
D. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示:
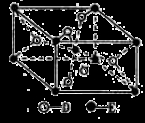
①Q(s)+2Cl2(g)=ECl4(l)+D2(g) △H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4和BD气体的热化学方程式:____________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
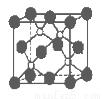
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目:高中化学 来源:2017届重庆八中高三上学期定时训练14化学试卷(解析版) 题型:填空题
化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-=FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只有在强碱性条件下稳定,易被H2还原。
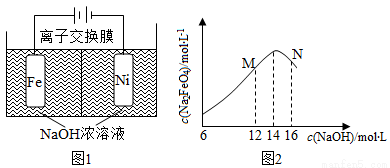
①电解一段时间后,c(OH-)降低的区域在__________(城 “阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
根据表中信息判断,下列选项正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2 、H2SO4 | K2SO4 、MnSO4 .. |
② | Cl2 、FeBr2 | FeCl3 、Br2 |
③ | MnO2...... | Cl2 、Mn2+ ... |
A.第①组反应的其余产物为H2O
B.第③组反应中生成1mol Cl2,转移电子4mol
C.氧化性由强到弱顺序为MnO4- > Fe3+>Cl2 >Br2
D.第②组反应中Cl2 与 FeBr2的物质的量之比为3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com