
【题目】以下能级符号不正确的是 ( )
A. 3s B. 3p C. 3d D. 3f
科目:高中化学 来源: 题型:
【题目】室温时,向20mL0.1000mol·L-1H2C2O4溶液中滴加0.1000mol·L-1NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示。下列有关叙述错误的是

A. 忽略H2C2O4的第二步电离,由题给信息,可以计算出常温下H2C2O4的电离常数
B. A、B、C三点所对应的溶液中,水的电离程度最小的是A点
C. A、B、C三点所对应的溶液中,均有c(Na+)<c(OH-)+c(HC2O4-)+2c(C2O42-)
D. 在B点溶液中,生成的含钠化合物有两种,且n(HC2O4-)+n(C2O42-)=2.0×10-3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与中和滴定类似,是用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。现用0. 00lmol/L酸性KMnO4溶液滴定未知浓度的NaHSO3溶液,请回答下列问题:
(1)完成滴定的离子方程式(在__中填系数,在___上填物质或离子):_____
____MnO4-+____HSO3-+____=____Mn2++___ ____+___H2O
(2)该滴定实验的仪器除了铁架台、滴定管夹外,还需要下列用品中的_____(填序号)
A.酸式滴定管 B.碱式滴定管 C.漏斗 D.锥形瓶 E.烧杯 F.白纸
(3) KMnO4溶液不能用____(酸、碱)式滴定管盛装,原因是:_______。
(4)是否需要选择指示剂?_____。滴定终点的现象是___________。
(5)滴定前平视KMnO4液面,刻度为amL,滴定后俯视液面刎度为bmL,则(b-a)mL比实际消耗KMnO4溶液体积_______(填“大”、“小”或“无影响”,下同)。根据(b-a) mL计算,得到NaHSO3的浓度比实际的浓度_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为0.5 L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色) ![]() N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。
N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。
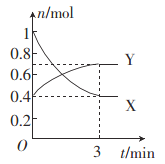
(1)曲线____(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)在0~3 min内,用NO2表示的反应速率为____________。
(3)下列叙述能说明该反应已达到化学平衡状态的是________(填字母)。
a.容器内压强不再发生变化
b.NO2的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolN2O4的同时生成2nmol NO2
(4)反应达到平衡后,若降低温度,则v(正)______,v(逆)________。(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响。
【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小。实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中。
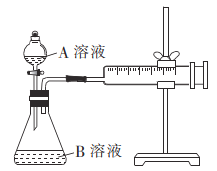
实验编号 | A溶液 | B溶液 |
① | 2 mL 0. 1 mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
② | 2 mL 0. 2 mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)该实验探究的是_______对反应速率的影响。实现该实验目的还欠缺的仪器:_______。比较①、②两组化学反应速率大小的方法是____________。
乙组方案:用4mL0.0l mol/L酸性KMnO4溶液与2 mL 0. 01 mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。具体实验如下:
实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | — |
Ⅱ | 2 | 20 | 少量MnSO4粉末 |
Ⅲ | 2 | 30 | — |
Ⅳ | 1 | 20 | 1mL蒸馏水 |
(3)若要研究催化剂对化学反应速率的影响,则应对比实验
若要研究温度对化学反应速率的影响,则应对比实验________。
(4)对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化碳生产化工产品,有利于二氧化碳的大量回收,二氧化碳和乙二醇在ZnO或锌盐催化下可合成碳酸乙烯酯。
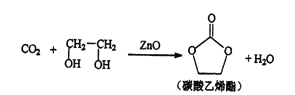
(1)锌基态原子核外电子排布式为_________________。
(2)锌盐水溶液中Zn2+可与H2O之间形成 [Zn(H2O)6]2+,其中提供空轨道的是______________(填微粒符号)。
(3)碳酸乙烯酯中碳原子杂化轨道类型为________;1mol碳酸乙烯酯中含有的σ键数目为________。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:(已知:Fe3+在PH=3.7时就完全生成氢氧化铁沉淀)

(1)“浸出”时,原料中的铜均转化为硫酸铜。写出相应的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除尽,你的检验方法是________________
(3)调节pH的目的是____________。从滤液到胆矾应采用_________________过滤。
(4)气体a可以被循环利用,用化学方程式表示其被循环利用的原理为:2NO+O2=2NO2、_________________
(5)在农业上,将胆矾、生石灰和水按一定比例混合制成波尔多液,其反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 在相同条件下PH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,水的电离程度前者比后者大
B. 反应NH3(g)+HCl(g) ![]() NH4Cl(s)能自发进行,则该反应ΔH>0
NH4Cl(s)能自发进行,则该反应ΔH>0
C. 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了c(H+)
D. 一定条件下,反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3)
2SO3(g) ΔH<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
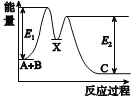
A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的ΔH<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com