
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 8 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
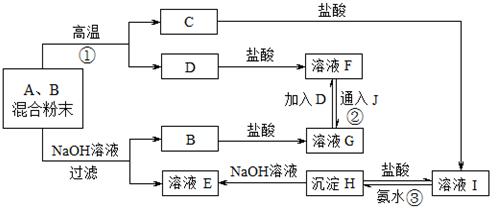
查看答案和解析>>
科目:高中化学 来源: 题型:
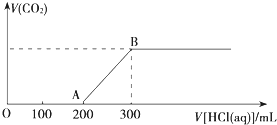 向100mL 3mol?L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol?L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl③CH3COONH4④NH3?H2O,c(NH4+)由大到小的顺序是:②>①>④>③ |
| B、室温下,向0.01mol?L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、向0.2mol?L-1NaHCO3溶液中加如等体积0.1mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、对于反应N2H4(l)=N2(g)+2H2(g)△H=-50.6kJ?mol-1在任何温度下都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a电极上有气体放出,b电极上无气泡,溶液pH变大 |
| B、a是正极,b是负极 |
| C、导线中有电子流动,外电路中,电子从a极到b极 |
| D、a极上发生了还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g金属钠变为钠离子时失去的电子数是0.1NA |
| B、0.5NA个氯分子所占体积约为11.2L |
| C、28g氮气所含原子数为2NA |
| D、18g水所含的质子总数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲酸为一元弱酸,在15mL 0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线.下面有关微粒浓度的大小关系正确的是( )
甲酸为一元弱酸,在15mL 0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线.下面有关微粒浓度的大小关系正确的是( )| A、在A、B间的任意一点上都存在:c(K+)>c(HCOO-)>c(OH-)>c(H+) |
| B、在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| C、在C点:c(HCOO-)>c(K+)>(H+)>c(OH-) |
| D、在D点:c(HCOO-)+c(HCOOH)=2c(K+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com