
|
��֪���� Cu(s)��H2O2(l)+2H+ (aq)��Cu2+(aq)��2H2O(l) ��H 1 ��2H2O(l)��2H2(g)��O2(g) ��H 2 ��2H2O2(l)��2H2O(l)��O2 (g) ��H 3 ��Cu(s)��2H+ (aq)��Cu2+(aq)��H2 (g) ��H4 ��H4����ȷ����ʽΪ�� ��
|
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������� |
| B����ʯ������ˮ |
| C��þ��ϡ���ᷴӦ |
| D�����������������Ȼ�茶����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��283. kJ��mol��1 | B��+172.5 kJ��mol��1 |
| C����172.5 kJ��mol��1 | D����504 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 N2��g��+CO2��g��ij�о�С��������ܱ������м���һ�����Ļ���̿��NO�����£�T�棩�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2��g��+CO2��g��ij�о�С��������ܱ������м���һ�����Ļ���̿��NO�����£�T�棩�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�| Ũ�ȣ�mol/L�� ʱ�䣨min�� | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
| n(SO32��)��n(HSO3��) | 91��9 | 1��1 | 1��91 |
| pH | 8.2 | 7.2 | 6.2 |
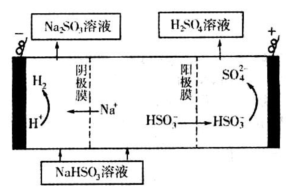
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
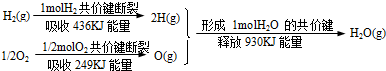
| A��1molH2��0.5molO2�����е�����������1mol��̬H2O�����е������� |
| B��������������Ӧ����ˮ��ͬʱ�������� |
| C��1molH2��1/2molO2��Ӧ����1molH2O(l)�ͷ�����һ����245kJ |
| D��2molH2(g)��1molO2(g)��Ӧ����2molH2O(g)�ͷ�����490kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����Т� | B�����Тڢ� | C�����Тڢۢ� | D��ȫ������Ҫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g) ��H1 ƽ�ⳣ��ΪK1
2SO3(g) ��H1 ƽ�ⳣ��ΪK1 2NO2(g) ��H2 ƽ�ⳣ��ΪK2
2NO2(g) ��H2 ƽ�ⳣ��ΪK2 SO3(g)+NO(g)�Ħ�H="______" (�æ�H 1�ͦ�H 2��ʾ)���˷�Ӧ���¶��µ�ƽ�ⳣ��K=______(��K1��K2��ʾ)��
SO3(g)+NO(g)�Ħ�H="______" (�æ�H 1�ͦ�H 2��ʾ)���˷�Ӧ���¶��µ�ƽ�ⳣ��K=______(��K1��K2��ʾ)�� C(g)+D(g)���÷�Ӧ��3L�ܱ������У������ֲ�ͬ�������½��з�Ӧ��A��B����ʼ���ʵ��Ƿֱ�Ϊ3.0mol��6.0mol������ʵ��I������ΪT1�档A�����ʵ�����ʱ��ı仯��ͼ��ʾ��
C(g)+D(g)���÷�Ӧ��3L�ܱ������У������ֲ�ͬ�������½��з�Ӧ��A��B����ʼ���ʵ��Ƿֱ�Ϊ3.0mol��6.0mol������ʵ��I������ΪT1�档A�����ʵ�����ʱ��ı仯��ͼ��ʾ��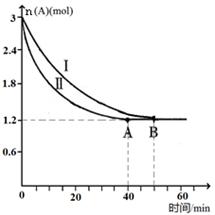
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)����H1����90 kJ��mol��1
CH3OH(g)����H1����90 kJ��mol��1 CO2(g)��H2(g)��H2����41 kJ��mol��1
CO2(g)��H2(g)��H2����41 kJ��mol��1
 CO2(g)��H2(g)��ƽ�ⳣ��K��0.32���ڸ��¶��£���֪cʼ(CO)��1 mol��L��1��cʼ(H2O)��1 mol��L��1��ijʱ�̾��ⶨCO��ת����Ϊ10%����÷�Ӧ________(��Ѿ�����û�С�)�ﵽƽ�⣬ԭ����_________________________________________________
CO2(g)��H2(g)��ƽ�ⳣ��K��0.32���ڸ��¶��£���֪cʼ(CO)��1 mol��L��1��cʼ(H2O)��1 mol��L��1��ijʱ�̾��ⶨCO��ת����Ϊ10%����÷�Ӧ________(��Ѿ�����û�С�)�ﵽƽ�⣬ԭ����_________________________________________________�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2(g) + H2(g)����Ӧ�����и����ʵ�Ũ������ͼt1ǰ��ʾ�仯���������¶Ȳ��䣬t2ʱ���������г���CO��H2��1mol��ƽ�⽫ �ƶ�������� �����ҡ���������t2ʱ�����ı䷴Ӧ����������H2Ũ�ȷ�������ͼt2����ʾ�ı仯����ı������������ ������ţ���
CO2(g) + H2(g)����Ӧ�����и����ʵ�Ũ������ͼt1ǰ��ʾ�仯���������¶Ȳ��䣬t2ʱ���������г���CO��H2��1mol��ƽ�⽫ �ƶ�������� �����ҡ���������t2ʱ�����ı䷴Ӧ����������H2Ũ�ȷ�������ͼt2����ʾ�ı仯����ı������������ ������ţ���


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com