
【题目】氨气是一种重要的化工产品,工业上可以按照下图所示流程生产氨气: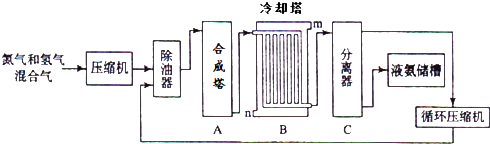
(1)原料气之一氮气的工业制取方法是 , 写出氨气的工业用途(任答一点) .
(2)写出合成塔中发生的反应的化学反应方程式 .
在冷却塔中对混合气体进行冷却,冷水的入口(答m或n).
(3)设备C的作用 .
其分离器中的过程对整个工业合成氨的意义 . (试结合平衡移动原理回答)
(4)在原料气制备过程中混有 CO对催化剂有毒害作用,欲除去原料气中的 CO,可通过如下反应来实现:CO(g)+H2O(g)CO2(g)+H2(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于(精确到小数点后一位).
【答案】
(1)分离液态空气;作制冷剂或制硝酸可制氮肥
(2)N2+3H2 ![]() 2NH3;n
2NH3;n
(3)将生成的液态氨气与未反应的原料气分离;氨气不断被液化分离,减小氨气的浓度,促使平衡不断正向移动,提高原料的利用率
(4)5.9
【解析】解:(1)空气中的近五分四的是氮气,所以工业上用分离液态空气的方法得到氮气,氨气可以作制冷剂或制硝酸可制氮肥,所以答案是:分离液态空气;作制冷剂或制硝酸可制氮肥;
(2.)工业合成氨中合成塔中的反应为氮气和氢气在高温高压条件下生成氨气,反应方程式为N2+3H2 ![]() 2NH3 , 采用逆流的方式冷却效果好,所以冷水从n处进入,所以答案是:N2+3H2
2NH3 , 采用逆流的方式冷却效果好,所以冷水从n处进入,所以答案是:N2+3H2 ![]() 2NH3;n;
2NH3;n;
(3.)设备C是分离塔,将生成的液态氨气与未反应的原料气分离,氨气不断被液化分离,减小氨气的浓度,促使平衡不断正向移动,提高原料的利用率,所以答案是:将生成的液态氨气与未反应的原料气分离;氨气不断被液化分离,减小氨气的浓度,促使平衡不断正向移动,提高原料的利用率;
(4.)设开始CO为amol/L,H2O为bmol/L,
CO(g) | + | H2O(g) | CO2(g) | + | H2(g) | |
a | b | |||||
0.2a | b﹣0.8a | 0.8a | 0.8a |
根据K= ![]() =
= ![]() =0.627,所以b:a=5.9,所以起始物中c(H2O):c(CO)不低于5.9,所以答案是:5.9.
=0.627,所以b:a=5.9,所以起始物中c(H2O):c(CO)不低于5.9,所以答案是:5.9.


科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( ) 
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe﹣2e﹣═Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y是元素周期表ⅠA族中的两种金属元素,下列叙述中能说明X的金属性比Y强的是( )
A.Y与水反应比X与水反应更剧烈 B.Y+离子的氧化性比X+离子强
C.YOH的碱性比XOH强 D.Y的原子半径比X大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从有机物A开始有如图所示的转化关系(部分产物略去).A在NaOH溶液中水解生成B、C和D,1molF与足量的新制Cu(OH)2碱性悬浊液加热充分反应可生成2mol红色沉淀.分析并回答问题: 
(1)A中含有的官能团为氯原子(﹣Cl)和、;
(2)指出反应类型:A→B、C、D; H→I;
(3)写出下列反应的化学方程式:
①C→F:;②E→H:;
(4)与E含有相同官能团的某有机物甲(C4H8O3)有多种同分异构体,在结构中含有酯基和羟基,且水解产物不存在两个羟基连在同一个碳上的同分异构体有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 27g铝箔在酒精灯上充分加热反应转移电子总数是3NA
B. 84g还原铁粉与水蒸气完全反应转移电子总数是4NA
C. 常温常压下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA
D. 7.8gNa2O2中含有的阴、阳离子的总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g)C(g),平衡时C 的体积分数为40%.
(1)欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 , C的体积分数为 .
(2)另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40%,则该密闭容器体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示:
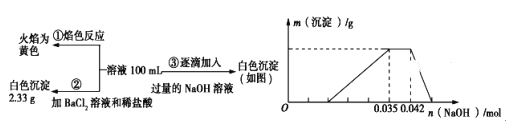
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是__________,一定存在的阳离子是______________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:_____________________________________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为___________,所得沉淀的最大质量是_________g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L-1,试判断原废水中NO3-是否存在?__________(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)=____________ mol·L-1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示: 
(1)该图中有两处仪器未画出,它们是、 .
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol) .
(3)取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm2 , 中和后生成溶液的比热容c=4.08J/(g℃).则中和热△H=(取小数点后一位).
(4)有关中和热测定实验,下列说法错误的是 a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度会导致中和热数值比57.3低
b.温度计的冲洗液应倒入小烧杯参与反应
c.混合硫酸和氢氧化钠溶液时应分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.若装置完全相同,操作均没失误,取110mLNaOH溶液和50mL硫酸溶液进行实验,误差比55mLNaOH溶液和25mL硫酸溶液进行实验误差小.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com