
分析 Ⅰ(1)根据溶液的配制的操作进行排序,配制稀硫酸、称量、溶解于稀酸中、加入铁粉(除去铁离子,防止亚铁离子被氧化)、过滤、滤液移入容量瓶,定容;
Ⅱ(1)通过消耗的高锰酸钾,根据方程式计算20.00mLFeSO4溶液中Fe2+的物质的量,再根据c=$\frac{n}{V}$计算FeSO4溶液浓度;
(2)滴定时,加入最后一滴KMnO4溶液,KMnO4溶液紫色不再褪去,且半分钟颜色不变,说明滴定到终点.
解答 解:Ⅰ(1)根据溶液的配制的操作进行排序,配制稀硫酸、称量、溶解于稀酸中、加入铁粉(除去铁离子,防止亚铁离子被氧化)、过滤、滤液移入容量瓶、定容,故操作步骤顺序为:A→B→C→E→D;
故答案为:C→E→D;
Ⅱ(1)酸性条件下,Fe2+被MnO4-氧化为Fe3+,MnO4-被还原为Mn2+,同时生成水,离子方程式为:5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O;
令20.00mL FeSO4溶液中Fe2+的物质的量为n,则:
5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O
5 1
n 0.10mol•L-1×0.02L
所以n=5×0.10mol•L-1×0.02L=0.01mol
所以FeSO4溶液浓度为$\frac{0.01mol}{0.02L}$=0.5mol/L
故答案为:0.5;
(2)滴定时,加入最后一滴KMnO4溶液,KMnO4溶液紫色不再褪去,且半分钟颜色不变,说明滴定到终点,不需要用指示剂,故选C;
故答案为:C;可利用KMnO4溶液紫色不再褪去判断滴定终点.
点评 本题考查亚铁盐溶液的配制、氧化还原反应滴定等,难度中等,注意溶液配制中要防止水解、氧化,注意基础知识的掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1 mol•L-1的Al2(SO4)3溶液中,Al3+的数目为0.2 NA | |
| B. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1 NA | |
| C. | 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为 0.1NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 常温常压下,0.1mol铁在0.1molC12中充分燃烧,转移的电子数为0.3NA | |
| C. | 0.1mol/L的K2CO3溶液中CO32-数小于0.1NA | |
| D. |  0.5mol雄黄(As4S4,结构如图)含有NA个S-S键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
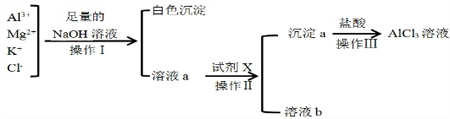 某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3+3H2O═Al(OH)3+3HCl | |
| B. | Na2CO3+2H2O?H2CO3+2NaOH | |
| C. | 碳酸氢钠溶液:HCO3-+H2O?H2CO3+OH-- | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中氧化剂与还原剂的物质的量之比为1:6 | |
| D. | 反应③中1mol还原剂反应,则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X.
将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
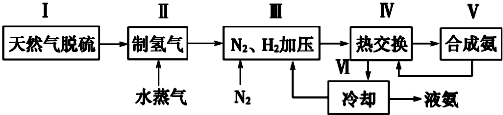
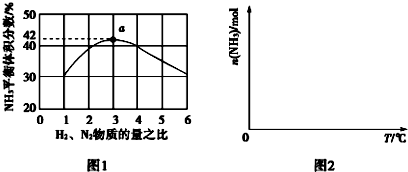
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com