

| Fe��OH��2 | Cu��OH��2 | Fe��OH��3 | |
| Ksp | 8.0��1016 | 2.2��1022 | 4.0��1038 |
| ��ȫ����pH | ��9.6 | ��6.4 | ��3.2 |
| c(NH4+)c(Cl-) |
| c(NH3?H2O) |
| 10-3��10-3 |
| 0.1 |
| c2(OH-)c(Cu(NH3)42+) |
| c4(NH3?H2O) |
| c2(OH-)c(Cu(NH3)42+) |
| c4(NH3?H2O) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
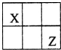 ����������Ԫ��X��Y��Z��W��ԭ��������������X��Y��Zԭ������֮����W��2����X��Z�����ڱ��е����λ����ͼ��ʾ��X������۾���ֵ����ԭ��������������ȣ�����˵������ȷ���ǣ�������
����������Ԫ��X��Y��Z��W��ԭ��������������X��Y��Zԭ������֮����W��2����X��Z�����ڱ��е����λ����ͼ��ʾ��X������۾���ֵ����ԭ��������������ȣ�����˵������ȷ���ǣ�������| A��ԭ�Ӱ뾶��Y��Z��W |
| B��һ�������£�Y���û���X |
| C����̬�⻯���ȶ��ԣ�Z��W |
| D���۵�YW2��XW4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij��ȤС����Ƴ���ͼ��ʾװ�����Ľ��̲��С�ͭ�����ᷴӦ��ʵ�飬��̽����ѧʵ�����ɫ����
ij��ȤС����Ƴ���ͼ��ʾװ�����Ľ��̲��С�ͭ�����ᷴӦ��ʵ�飬��̽����ѧʵ�����ɫ����| ���� | ��Ӧ�� |
| �� | Cu��ŨHNO3 |
| �� | Cu��ϡHNO3 |
| �� | Cu��O2��ϡHNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A��װ�âٲⶨ��ѧ��Ӧ���� |
| B��װ�â���ȡ������HCl |
| C��װ�â���ȡ8.5mL��ϡ���� |
| D��װ�â�ģ�����ĸ�ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������7.8% |
| B������8% |
| C������ 8% |
| D���� 7.8% |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com